22. Évolution de la réponse à la température
Introduction
La température de l’environnement est une variable qui façonne la vie sur terre et est un agent de sélection puissant. Dans ce chapitre, nous verrons comment les systèmes physiologiques et cellulaires des organismes multicellulaires font face aux défis liés aux températures rencontrées dans leur milieu, que ce soit par des adaptations, la capacité d’acclimatation (qui est elle-même une adaptation), ou la plasticité du développement. Nous verrons comment la performance thermique et les températures critiques d’un organisme sont mesurées par les physiologistes. Nous verrons plus en détail les stratégies physiologiques face au gel, incluant le cas de poissons marins vivant dans l’océan Antarctique. Cela nous amènera à discuter du rôle des protéines structurantes de la glace qui ont des propriétés « anti-gel », ainsi que leur évolution par duplication et néo-fonctionnalisation. Nous verrons finalement que ces protéines se retrouvent sous différentes formes et ont évolué de façon répétée chez différents groupes de poissons à travers les eaux de la planète, incluant par évolution d’un gène de novo.
Objectifs d’apprentissage
À la fin de ce chapitre, vous serez en mesure de :
- Expliquer pourquoi la température est un agent de sélection des organismes sur terre
- Expliquer les adaptations des organismes face aux variations de température
- Expliquer comment la plasticité phénotypique et l’acclimatation peuvent être impliquées dans la survie face aux variations de température
- Expliquer comment se mesure la performance thermique
- Expliquer comment on estime la température critique minimale et maximale
- Décrire les différents changements physiologiques et cellulaires qui permettent de faire face au gel
- Contraster les caractéristiques des différents types de cryoprotecteurs
- Connaitre les différents traits des poissons de l’antarctique qui contribuent à la tolérance au gel
- Expliquer le phénomène d’évolution compensatoire et l’appliquer au cas des poissons Channichthyidae
- Contraster les différentes hypothèses expliquant la perte du système de transport de l’oxygène chez les poissons de glace
- Expliquer comment la présence de protéines structurantes de la glace augmente la tolérance au gel des Channichthyidae
- Appliquer le concept de duplication et néo-fonctionnalisation à un cas réel
- Tester l’hypothèse de l’évolution convergente à l’aide d’un arbre phylogénétique et des séquences d’ADN
- Définir le processus d’évolution de gène de novo
Notions clés
- La température comme agent de sélection
- Les adaptations des organismes pour faire face à des variations de température
- Acclimatation à la température et plasticité développementale
- La performance thermique
- La température critique minimale et maximale
- Les stratégies cellulaires face au gel
- Les cryoprotecteurs
- Traits divergents chez certains poissons de l’Antarctique
- Absence d’hémoglobine et de myoglobine
- Évolution compensatoire
- Agents de sélection potentiels menant à la perte d’un système de transport de l’oxygène
- Protéines structurantes de la glace chez les poissons de glace
- Évolution des protéines AGFP par duplication et néo-fonctionnalisation
- Évolution convergente des protéines structurantes de la glace chez les poissons
- Évolution de gène de novo
1. La température comme agent de sélection
La section 1 est adaptée de [1, 2].
La température est un des facteurs environnementaux les plus importants en physiologie, car elle exerce une influence sur toutes sortes de réactions biochimiques. La plupart des réactions chimiques catalysées par des enzymes sont affectées par la température, tel que décrit par la loi d’Arrhenius. Généralement, à mesure que la température corporelle augmente, l’activité enzymatique augmente également. Ainsi, pour chaque élévation de température de dix degrés Celsius, le coefficient de vitesse de la réaction est multiplié par un facteur de 2 à 3, dans les gammes de température où la plupart des organismes vivent (et inversement lors d’une baisse de température). Les protéines, y compris les enzymes, commencent à se dénaturer et perdent leur fonction à haute température (environ 50 °C pour les mammifères). En résumé, la température affecte directement la « vitesse de la vie ». Nous allons voir comment cela se traduit en physiologie, principalement chez les animaux.
2. Les adaptations des organismes pour faire face à des variations de température
La section 2 est adaptée de [3, 4].
Il y a de nombreuses formes d’adaptations physiologiques face aux variations de température. Les animaux peuvent être divisés en deux groupes, selon leur stratégie face aux variations de température : les homéothermes qui maintiennent une température corporelle à l’intérieur d’une gamme étroite face à des températures environnementales différentes et les poïkilothermes qui ont une température corporelle qui varie avec l’environnement. On peut aussi classer les animaux selon leur source de température corporelle. Les ectothermes dépendent des températures extérieures pour régler leur température corporelle et les endothermes sont des animaux qui dépendent de sources internes pour la réguler. Ainsi un animal peut être ectotherme (il ne produit pas de source de chaleur significative de façon interne) et être aussi classifié comme un homéotherme, car il montre des stratégies comportementales pour maintenir l’homéostasie de sa température corporelle.
Les endothermes et certains ectothermes vont garder leur température à l’intérieur d’une certaine gamme de valeurs à l’aide de divers processus. La chaleur peut être échangée entre un animal (homéotherme ou ectotherme) et son environnement par quatre mécanismes : rayonnement, évaporation, convection et conduction (figure 22.1). Le rayonnement thermique est l’émission d’ondes électromagnétiques de « chaleur », par exemple en provenance du soleil ou à partir de la peau sèche. La chaleur peut être évacuée avec un liquide d’une surface pendant l’évaporation. Cela se produit par exemple lorsqu’un mammifère transpire. Le transfert thermique par convection se passe par exemple lorsqu’un courant d’air évacue la chaleur de la surface de la peau sèche. Les animaux utilisent leur système circulatoire afin de maintenir la température corporelle. La vasodilatation apporte plus de sang à la surface du corps, facilitant le rayonnement et la perte de chaleur, ce qui aide à refroidir le corps. Inversement, un animal qui construit un terrier ou autre habitat qui permet de garder l’air chaud s’en servira pour se réchauffer. Il y a transfert thermique par conduction lorsqu’une surface est en contact avec une autre surface, comme un animal se reposant sur une roche chaude ou au contraire se refroidissant en contact avec un milieu plus froid, comme en s’immergeant dans un liquide, se couvrant de boue froide ou en s’allongeant sur un sol plus frais.
![Figure 1. Mécanismes d’échange de chaleur entre un animal et son environnement. Adapté de [5].](https://pressbooks.etsmtl.ca/app/uploads/sites/5/2023/11/U3C22F1-1024x686.png)
Les animaux conservent la chaleur de diverses manières. Dans certains climats, les animaux endothermes ont une certaine forme d’isolation, comme la fourrure, la graisse, les plumes ou une combinaison de ceux-ci pour conserver la chaleur. Par exemple, les ours polaires et les phoques vivent et nagent dans un environnement sous le point de congélation tout en maintenant une température corporelle pratiquement constante. La perte de quantités importantes de graisse corporelle compromet la capacité d’un individu à conserver la chaleur. Le système circulatoire peut être mis à contribution pour conserver la chaleur. La vasoconstriction réduit le flux sanguin dans les vaisseaux sanguins périphériques, forçant le sang vers le noyau et les organes vitaux qui s’y trouvent, et conservant la chaleur. Certains animaux ont des adaptations de leur système circulatoire qui leur permettent de transférer la chaleur des artères aux veines, réchauffant le sang retournant au cœur. C’est ce qu’on appelle un échange de chaleur à contre-courant; il empêche le sang veineux froid de refroidir le cœur et les autres organes internes. Cette adaptation peut être interrompue chez certains animaux pour éviter la surchauffe des organes internes. L’adaptation de circulation à contre-courant se retrouve chez de nombreux animaux, notamment les dauphins, les requins, les poissons osseux, les abeilles et les colibris.
Certains animaux ectothermes adoptent des comportements qui ont pour effet de modifier leur température corporelle. Par exemple, un animal ectotherme du désert peut rechercher des zones plus fraiches pendant la partie la plus chaude de la journée, ce qui baissera sa température corporelle. Les mêmes animaux peuvent grimper sur des rochers pour capter la chaleur pendant une nuit froide du désert (figure 22.2A). Certains animaux recherchent de l’eau pour faciliter l’évaporation en les refroidissant, comme on le voit avec les reptiles. D’autres ectothermes utilisent une activité de groupe pour réguler leur température, comme le mouvement des abeilles pour réchauffer une ruche l’hiver, ou le regroupement de lézards lorsque la température est basse (figure 22.2B-C).
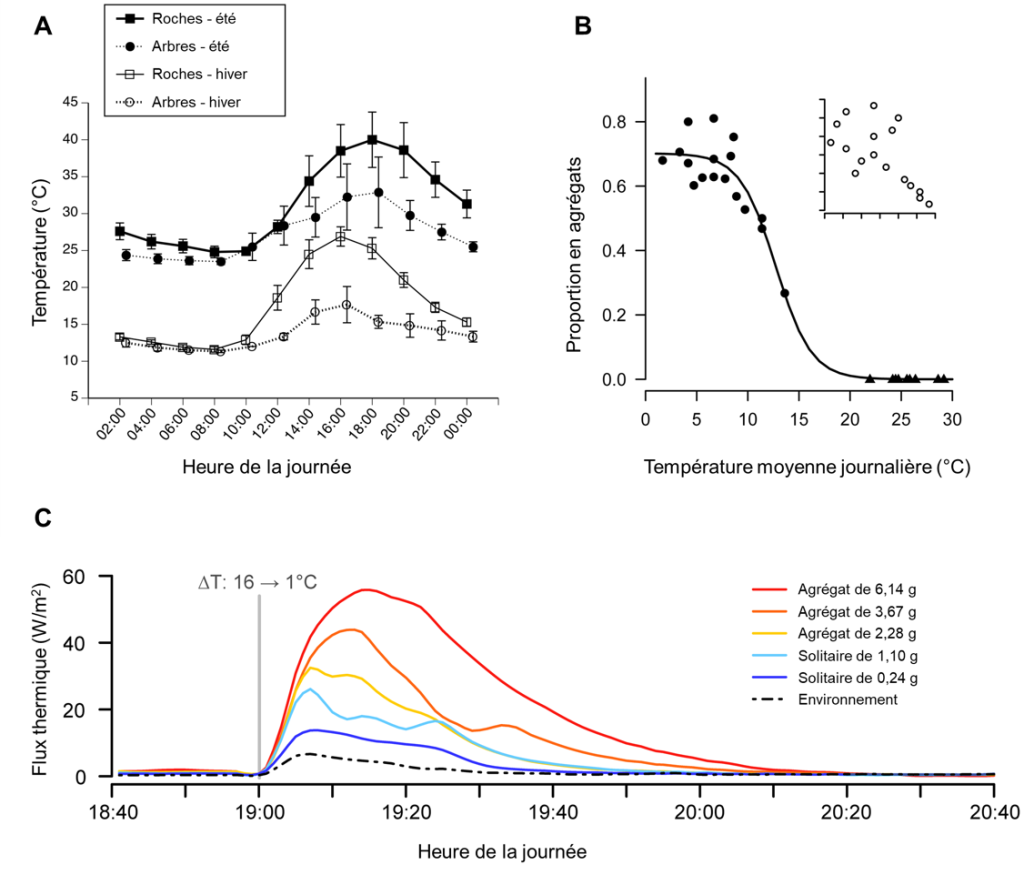
De nombreux animaux, en particulier les mammifères, utilisent la chaleur résiduelle métabolique pour modifier leur température. Lorsque les muscles sont contractés, la majeure partie de l’énergie de l’ATP utilisée dans les actions musculaires est une énergie résiduelle qui se traduit par de la chaleur. Cette énergie résiduelle liée aux contractions est ce qui est utilisé lors du réflexe de frisson, qui génère de la chaleur pour le corps. De nombreuses espèces ont également un type de tissu adipeux appelé graisse brune qui se spécialise dans la production de chaleur. La torpeur de courte durée qui se produit chez les petits endothermes comme les chauves-souris, certains marsupiaux et oiseaux, est un trait adaptatif qui réduit temporairement leurs taux métaboliques élevés, ce qui permet la conservation de l’énergie durant une période où la température baisse, par exemple la nuit. On peut aussi inclure dans ces adaptations aux variations de température l’hibernation et l’estivation.
Exercices
Adaptation pour faire face aux variations de températures
3. Acclimatation à la température et plasticité du développement
La capacité d’un individu à faire face à une certaine température n’est pas statique. En effet, les systèmes physiologiques d’un animal peuvent s’acclimater à une température plus chaude ou plus froide. Le processus d’acclimatation peut modifier la gamme de valeur dans laquelle un organisme peut vivre. Ainsi, si au fil des jours ou des semaines l’individu est exposé à une température qui augmente de façon lente et constante, il est possible que cet individu survive et ait une performance élevée, alors qu’un transfert abrupt de la température originale vers la température finale aurait résulté en la mort de cet individu. Cette capacité d’acclimatation est une adaptation, car cette capacité améliore le fitness de l’individu.
De plus, l’environnement où se développe un organisme peut affecter sa capacité à faire face à une certaine gamme de température pour le reste de sa vie, ce qui est un cas de plasticité phénotypique.
4. La performance thermique
Nous avons une idée de la plage de températures à laquelle un organisme multicellulaire peut faire face pour de nombreuses espèces, que ce soit chez les plantes, les champignons ou les animaux. Cette information permet de comprendre le lien entre la physiologie et l’écologie de l’espèce, par exemple son aire de distribution géographique. La température peut affecter la phénologie, c’est-à-dire le calendrier des évènements de l’histoire de vie des organismes qui est affecté par des variables de l’environnement comme la température et la photopériode. On peut penser à la date de nidification d’une espèce d’oiseaux, la date de floraison d’une plante, ou la migration d’un poisson. Ce type d’information permet donc aussi de modéliser comment la répartition et la phénologie de la population changera (ou change déjà dans certains cas) avec les changements climatiques et les autres modifications de l’environnement liés à l’activité humaine (barrage qui change les débits d’eau ou rejette de grandes masses d’eau soudainement, ce qui affecte la température de l’eau, urbanisation qui créé des ilots de chaleur, agriculture extensive qui élimine les refuges thermiques boisés, etc.).
On peut quantifier la gamme de température à l’intérieur de laquelle la performance d’un individu est viable en mesurant sa réponse à différentes températures. On peut utiliser différents traits comme indicateur de performance, à différents niveaux d’organisation biologique et avec différentes échelles de temps. La plupart du temps ce sont des « taux » qui sont mesurés. Le plus souvent, la réponse qu’on mesurera sera liée à des modifications actives au niveau physiologique, ce qui implique le système sensoriel, le centre d’intégration du système nerveux et un effecteur (un organe comme un muscle, une glande endocrinienne, etc.). Les traits les plus souvent étudiés incluent le taux de croissance, le taux d’alimentation, les battements cardiaques, la quantité d’oxygène utilisé par minute (taux métabolique), la distance parcourue en un temps donné (vitesse de locomotion), le taux de photosynthèse, ou le taux de substrat converti par unité de temps (si on quantifie la performance comme étant l’activité enzymatique à cette température). Avec ces expériences, on obtiendra de l’information sur la gamme de température permissive où l’organisme est en mesure de compléter son cycle de vie (on appelle souvent cette gamme la « zone de tolérance »). On peut créer une courbe de performance thermique pour représenter les capacités moyennes d’individus avec des caractéristiques similaires (figure 22.3). On peut aussi utiliser cette courbe pour déterminer la température optimale, soit celle où la performance pour un trait donné est maximale. Ces courbes de performance ont été reliées dans certains cas à des traits de performance critique pour la survie en milieu naturel, comme la capacité de migrer chez certains poissons [8, 9].
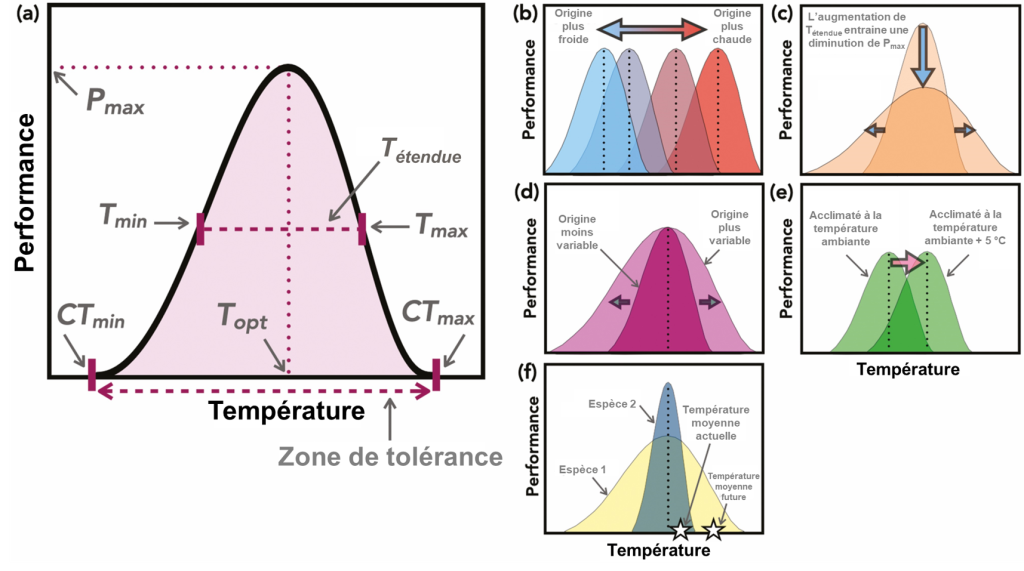
5. La température critique minimale et maximale
Les physiologistes utilisent une méthode où ils augmentent ou diminuent la température ambiante de façon constante et rapide pour créer un stress aigu, ce qui leur permet d’estimer la température critique minimale et maximale (connus comme CTmin et CTmax dans la littérature scientifique anglophone) d’un organisme. Cette mesure est identifiée comme la température où l’activité locomotrice de l’animal devient désorganisée et qu’il perd l’équilibre (figure 22.3A). Les physiologistes arrêtent l’expérience à ce moment pour que le traitement ne soit pas létal. Le taux d’augmentation de la température pour mesurer le CTmax doit être constant pour une étude donnée et assez rapide pour éviter que l’acclimatation n’entre en jeu. Cependant pour les études en milieu aquatique, il est possible qu’un taux d’augmentation différent doive être utilisé pour différentes espèces ou même différents stades de vie qui diffèrent en taille de façon significative, car le temps nécessaire pour que le corps de l’animal soit à la même température que l’eau varie avec la taille, qui affecte le ratio surface/volume. Dans ce type d’expérience, l’organisme est au-delà de sa gamme de température permissive et il passe dans la « zone de résistance » qui est une condition stressante qui mènera à sa mort si on le laisse dans cet état. Cette valeur de Ctmax a une pertinence écologique, car elle été reliée à la performance de l’organisme, par exemple chez les poissons. Ces études se font le plus souvent en laboratoire où on peut contrôler les paramètres de l’expérience, mais l’amélioration des biosenseurs que l’on peut implanter chez un animal et des appareils servant à mesurer des isotopes stables permettent de faire certaines mesures en conditions naturelles en recueillant les données en temps réel ou après coup (battements cardiaques liés à la vitesse de locomotion, quantité de CO2 produit sur une certaine période de temps) [8, 9].
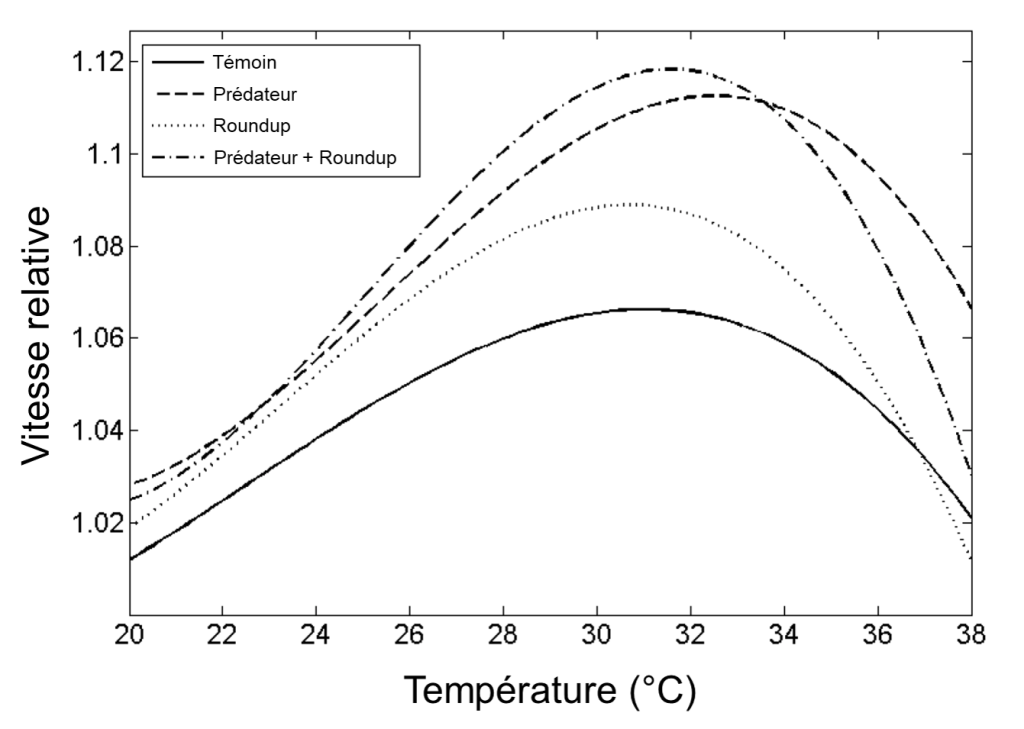
Ces courbes de performance thermiques et les valeurs de CTmin et CTmax sont la représentation de la variation d’un trait de l’organisme en réponse à différentes températures. Elles peuvent donc changer selon les caractéristiques de l’individu (stade de vie, taille, sexe), la présence ou non d’acclimatation (et la durée de l’acclimatation) (figure 22.3E), l’environnement durant le développement (plasticité phénotypique) et la sélection naturelle (figure 22.3B). Bien sûr, ces mesures de tolérance thermique et de performance thermique ne représentent pas nécessairement le milieu naturel, car on fait varier la température de façon aigüe. Il ne faut donc pas se fier uniquement à ces mesures pour prédire les effets sur une espèce dans son habitat, surtout si la réponse à une exposition aigüe s’avère différente si un second stresseur est présent, comme une variation de la pression partielle d’oxygène ou un prédateur (figure 22.4). Cependant, plusieurs études ont démontré un lien entre ces mesures et la performance et le fitness en milieu naturel et leur utilité pour déterminer quel stade de vie est le plus vulnérable aux changements environnementaux (figure 22.3F) [8, 9, 11].
Exercices
Courbe de performance thermique
6. Les stratégies cellulaires face au gel
Nous avons déjà parlé des températures élevées où les organismes atteignent leur CTmax. La température qui baisse affecte aussi le fonctionnement des cellules et cette baisse peut se rendre jusqu’à atteindre le point de congélation. Si l’organisme qui fait face à cet environnement est ectotherme, ses fluides intra et intercellulaires peuvent geler. La formation de glace dans le milieu interne peut causer des dommages mécaniques et empêcher la cellule de maintenir son homéostasie. Comment faire pour éviter ce risque? Il y a différentes stratégies : un organisme peut se déplacer et ainsi éviter comportementalement le gel par une migration, en s’enfouissant, ou en se cachant sous la glace d’une masse d’eau qui ne gèle pas, comme certaines tortues et grenouilles (figure 22.5) [13].

Un organisme peut aussi se déshydrater en éliminant l’eau de ses tissus qui pourraient geler. C’est le cas de plusieurs espèces de tardigrades [15]. De plus, un organisme peut aussi modifier la composition de ses fluides pour empêcher la cristallisation de l’eau. Comme c’est la formation de cristaux qui endommage les cellules et les tissus, stopper la cristallisation est bénéfique. Dans les organismes qui ont ces modifications, l’eau gèle mais sans faire de cristaux. C’est ce qu’on appelle la « vitrification » retrouvée par exemple chez certains nématodes de l’antarctique.
Une autre stratégie consiste à éviter le gel des fluides intracellulaires. Les espèces utilisant cette stratégie sont capables de survivre à de basses températures en abaissant le point de congélation des fluides des compartiments extracellulaires de leur corps via l’accumulation de cryoprotecteurs (« cryo » veut dire froid). Elles peuvent ainsi prévenir la formation de cristaux dans leur fluide ou permettre le gel dans certains tissus spécifiques, tout en en protégeant d’autres. Par exemple, les prénymphes de l’agrile du frêne, Agrilus planipennis peuvent survivre à des expositions prolongées à des températures inférieures à zéro, à condition qu’elles ne gèlent pas, et en hiver ont des points de surfusion inférieurs à − 25 °C. La surfusion est l’état d’une matière qui demeure en phase liquide alors que sa température est plus basse que son point de solidification [16]. Ici, le point de surfusion est la température à laquelle la formation spontanée de glace est initiée dans les fluides corporels de l’insecte. Finalement, il existe des exemples d’organismes qui peuvent tolérer et survivre au gel d’une partie de leurs tissus et de leur corps — ceux qui tolèrent le gel. On retrouve cette stratégie entre autres chez certains amphibiens comme la grenouille des bois (voir vidéo) et chez des insectes, incluant la mouche Chymomyza costata, qui est capable de survivre à l’immersion dans l’azote liquide [17].
Comment une grenouille survie-t-elle à l’hiver ?
Smithsonian Channel. (2015). Frogsicles: Frozen But Still Alive [Vidéo]. Youtube. https://www.youtube.com/watch?v=pLPeehsXAr4
6. 1 Les cryoprotecteurs
Au niveau cellulaire, les organismes qui ont comme stratégie d’éviter le gel tout en étant exposés à des températures sous le point de congélation produisent des cryoprotecteurs. Dans une cellule qui ne contient pas de cryoprotecteurs, les dommages se font comme suit : la congélation commence dans les fluides extracellulaires soit par contact cutané avec la glace externe, soit par l’action des agents de nucléation de la glace. L’osmolalité des fluides extracellulaires augmente parce que les solutés sont exclus des cristaux de glace et leur concentration augmente donc dans les fluides subsistants. L’eau sort donc des cellules en suivant le gradient d’osmolarité qui est plus élevé dans le liquide extracellulaire. Cela affecte le volume de la cellule jusqu’à une valeur critique à partir de laquelle les membranes sont endommagées. Si la cellule a une membrane qui ne la protège plus entièrement, la glace peut atteindre le cytoplasme. Les cryoprotecteurs produits par certaines espèces changent le destin de la cellule face à un environnement sous le point de congélation.
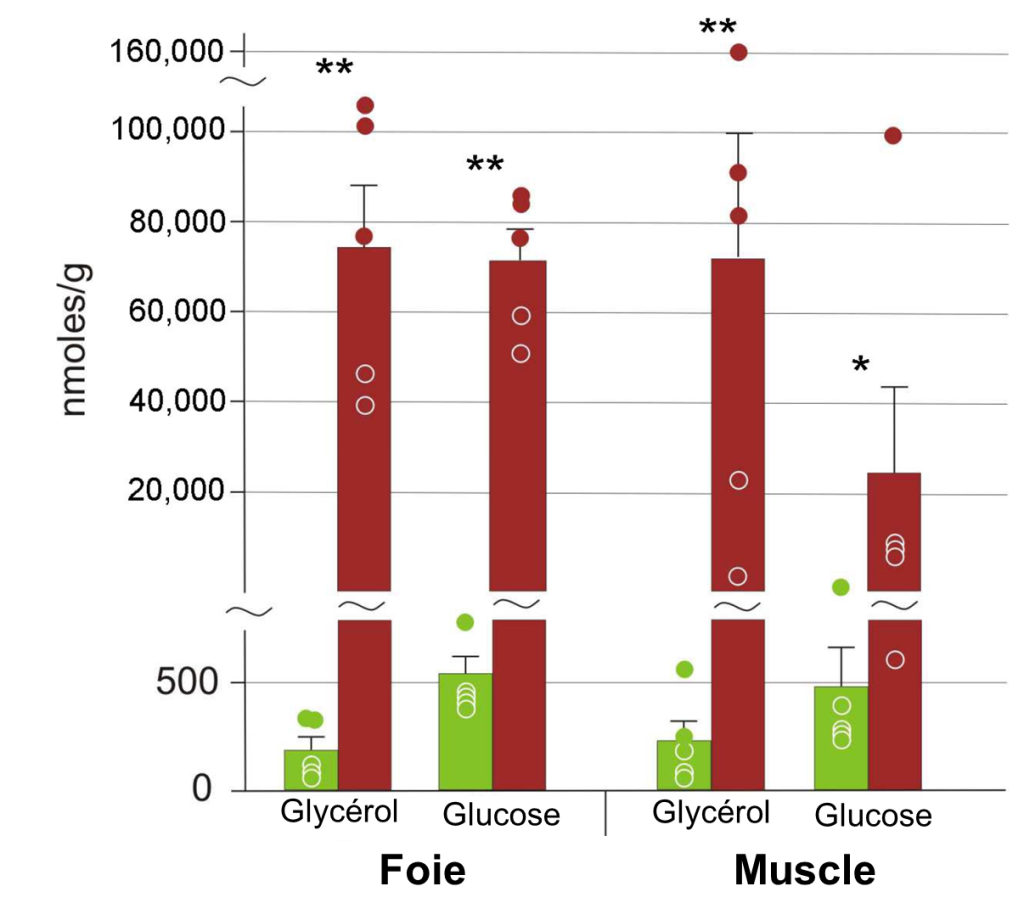
Parmi ces cryoprotecteurs, on retrouve des molécules de faible masse (sucres, glycérol, urée) produites par le foie. Ces molécules augmentent l’osmolalité des fluides intracellulaires et réduisent la probabilité de formation de glace. Ainsi, chez certains amphibiens qui peuvent geler en partie, on verra une augmentation du glucose dans différents tissus comparativement à une grenouille témoin (figure 22.6). Il y a donc une acclimatation de l’individu à la température sous le point de congélation.
On trouvera aussi des lipides et molécules associées qui empêchent la cristallisation et qui modifient les propriétés des membranes cellulaires. Finalement, on trouvera chez certaines espèces des protéines structurantes de la glace. Ces protéines agissent de trois façons. Premièrement, elles empêchent la formation de glace. Deuxièmement, elles contrôlent la taille des cristaux en évitant la recristallisation où de petits cristaux fusionnent et deviennent de gros cristaux plus dommageables. Troisièmement, elles sont des agents nucléants de la glace dont l’action résulte en une congélation lente et contrôlée de l’eau extracellulaire dans certains tissus spécifiques. Dans une cellule contenant des cryoprotecteurs, les protéines structurantes de la glace aident à contrôler la croissance des cristaux et inhibent la recristallisation afin que la taille des cristaux reste petite. Il y a une augmentation du nombre de transporteurs membranaires qui ont pour action de distribuer l’eau et des molécules cryoprotectrices entre les espaces intra et extracellulaires. De plus, la structure bicouche de la membrane peut être stabilisée par des glycolipides. Ces différentes stratégies ont évolué de nombreuses fois chez différents groupes (bactéries, levures, insectes, arachnidés, mollusques et crustacés marins, nématodes, plantes, champignons, poissons, reptiles, amphibiens, tardigrades). Les protéines « antigel » qui ont évolué de façon convergente dans différents groupes sont ainsi très variées (figure 22.7) [19-21].
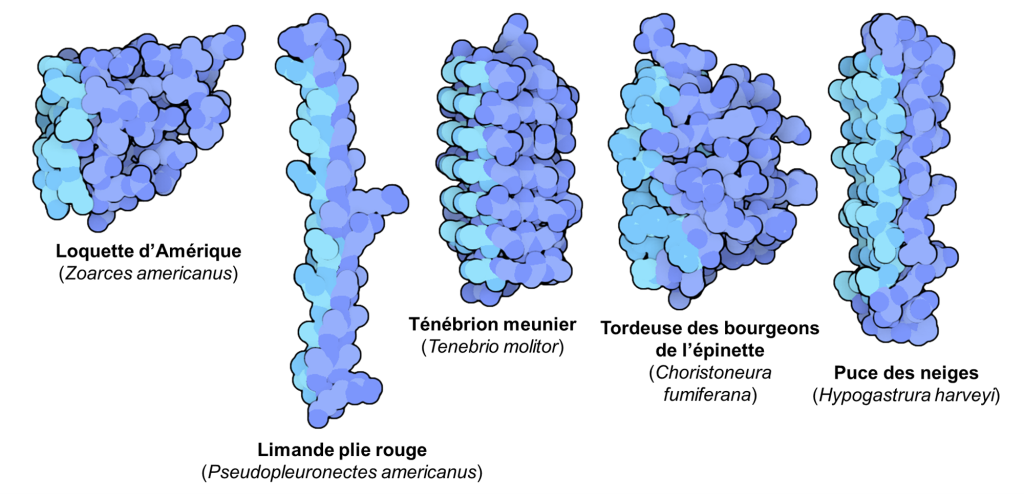
Des biologistes étudient ces protéines dans les plantes dans un but appliqué, afin de créer des plantes domestiquées pour la culture qui sont résistantes au froid. Une version synthétisée en laboratoire d’une protéine structurante de la glace trouvée chez un insecte est maintenant utilisée dans le secteur alimentaire afin d’empêcher les cristaux de glace dans des produits congelés, comme de la crème glacée, ce qui préserve la texture et le gout [19-21, 23].
Comment les protéines antigels affectent la croissance des cristaux de glace.
ICMS. (2016). Antifreeze proteins: shaping ice crystal growth [Vidéo]. Youtube.https://www.youtube.com/watch?v=uoRgpqAVsTE
Exercices
Les cryoprotecteurs
7. Traits divergents chez certains poissons de l’antarctique
Nous allons voir un exemple d’adaptation au froid qui permet de revenir sur ces protéines structurantes de la glace, de découvrir d’autres traits qui sont probablement des adaptations face au gel et aussi de réviser des concepts de biologie évolutive.
En Antarctique, l’environnement marin est particulièrement hostile. En raison de sa salinité, l’eau est sous forme liquide tout en étant à une température très constante de -1,9 Celsius. La température y est très stable et le brassage vertical des masses d’eau rend la colonne d’eau très uniforme en température. Cette basse température est associée à une saturation en oxygène élevée. On y retrouve un sous-ordre de poissons, les notothenioidei qui vivent dans ces eaux très froides. Ce sous-ordre compte 8 familles et représente 35 % des espèces présentes en Antarctique, ainsi que 90 % de la biomasse des poissons. Il est donc intéressant de voir quels traits ont divergé chez ces espèces. Nous nous concentrerons sur le cas d’une famille comprenant 16 espèces dénommés « icefish » (poissons de glace), les Channichthyidae (figure 22.8).
Dans cette famille de poissons, on retrouve des traits spécifiques qui ont été proposés comme des adaptations à la vie en eau glacée (mais nous y reviendrons!). Ces poissons n’ont pas d’écailles. Aucune des 16 espèces ne produit d’hémoglobine et 6 espèces ne produisent pas de myoglobine dans leurs muscles ni de globules rouges. Leur sang est donc clair et ces poissons semblent transparents. Ils produisent des protéines structurantes de la glace. Ils ont un grand volume sanguin, jusqu’à 4 fois celui d’un poisson de l’Antarctique d’une autre famille, un débit cardiaque de 4 à 5 fois plus grand qu’un poisson de même taille d’une autre famille et ont de plus grandes branchies, ainsi que des capillaires sanguins de plus grand diamètre. Finalement, leurs reins n’ont pas de glomérule [27-29].
Découverte d’un habitat de reproduction d’une espèce de poissons de glace
Guardian News. (2022). Huge icefish colony of 60 million nests found on Antarctic seabed [Vidéo]. Youtube. https://www.youtube.com/watch?v=t_bbLIYhHbg
7.1 Absence d’hémoglobine et de myoglobine
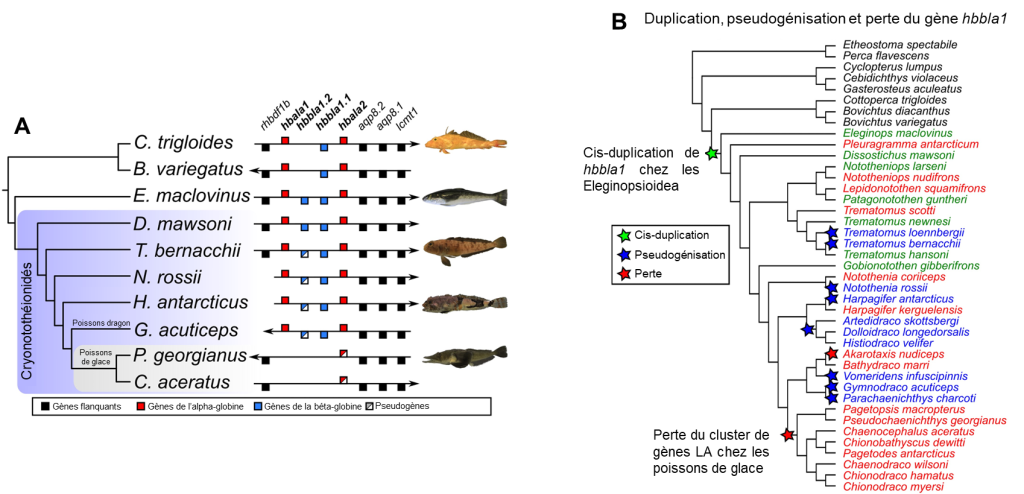
Avant la découverte de ces poissons Channichthyidae, il était convenu que l’hémoglobine est essentielle à la vie pour les vertébrés adultes. Des biologistes ont démontré que la pseudogénisation du gène qui code pour l’hémoglobine alpha s’est produite une seule fois dans l’ancêtre de la famille des poissons de glace, ce qui a rendu l’hémoglobine alpha non fonctionnelle pour le transport de l’oxygène (α-globine dans la figure 22.9). L’hémoglobine bêta et la myoglobine ont aussi des formes non fonctionnelles. Cette famille de poisson a donc perdu son système de transport des gaz.
7.1.2 Évolution compensatoire
Cette absence de système de transport de l’oxygène et du CO2 est associée à un phénomène d’évolution compensatoire, c’est-à-dire que plusieurs autres traits ont évolué à la suite de la disparition du système de transport de l’oxygène. Il a été proposé que les changements des composantes des systèmes respiratoire et circulatoire des poissons de glace (volume sanguin, branchies, débit cardiaque, vaisseaux) « compensent » pour la perte d’hémoglobine et de globules rouges. Ce sont des traits qui ont évolué en réponse à la pression de sélection causée par les problèmes qu’amène la perte de l’hémoglobine [28, 29]. Un autre exemple d’évolution compensatoire dans ce système concerne l’excrétion de CO2 qui est facilitée par la catalyse de bicarbonate en CO2 au site d’échange avec le monde extérieur, grâce à l’enzyme anhydrase carbonique. Chez les vertébrés, cette enzyme se trouve principalement dans les globules rouges, qui sont absents chez les poissons de glace. Des physiologistes ont découvert que l’enzyme se trouve dans les tissus des branchies, ce qui est inhabituel chez un poisson osseux. L’expression de cette enzyme dans un nouveau tissu est donc peut-être une adaptation apparue à la suite de la perte des globules rouges (et de l’enzyme carbonate anhydrase qui s’y trouvait), un cas d’évolution compensatoire [31].
7.1.3 Agents de sélection potentiels menant à la perte d’un système de transport de l’oxygène
Les premières études sur ces poissons sans hémoglobine fonctionnelle qui est maintenant sous forme de « fragment » dans le génome (figure 22.9) ont proposé que cela donne un avantage, car leur sang reste plus fluide, ce qui est important à la température à laquelle ils vivent. Cependant, des études récentes ont démontré que cette hypothèse, bien que plaisante à l’esprit, n’est pas entièrement supportée par les données physiologiques. Des physiologistes ont démontré que les couts associés à la perte de l’hémoglobine en termes d’énergie qui doit être dépensée pour faire fonctionner un plus gros cœur qui pompe un plus grand volume sanguin sont supérieurs aux avantages procurés par une plus grande fluidité sanguine. En effet, cette perte d’hémoglobine affecte le transport de l’oxygène, qui est transporté dans le plasma et par diffusion à travers la peau sans écaille. Ces poissons ont 10 fois moins de capacité de transport de l’oxygène que les autres familles de Nototheinoidés, même en ayant des traits cardiovasculaires très en dehors des normes qui compensent donc seulement en partie la perte d’hémoglobine et de globules rouges. Les calculs suggèrent que 22 % du métabolisme de base de ces poissons est voué au fonctionnement de leur cœur, alors qu’une espèce de poisson moyenne alloue 0,5 à 5 % de son métabolisme à ce compartiment physiologique. Ces physiologistes ont donc émis l’hypothèse que la perte de la fonction de l’hémoglobine n’est pas une adaptation à la vie en milieu très froid et a même des conséquences négatives pour le fitness. Selon ces physiologistes, l’absence de compétition dans ces milieux hostiles est une explication probable pour le maintien de cette famille de poisson et la spéciation en 16 espèces [28, 29].
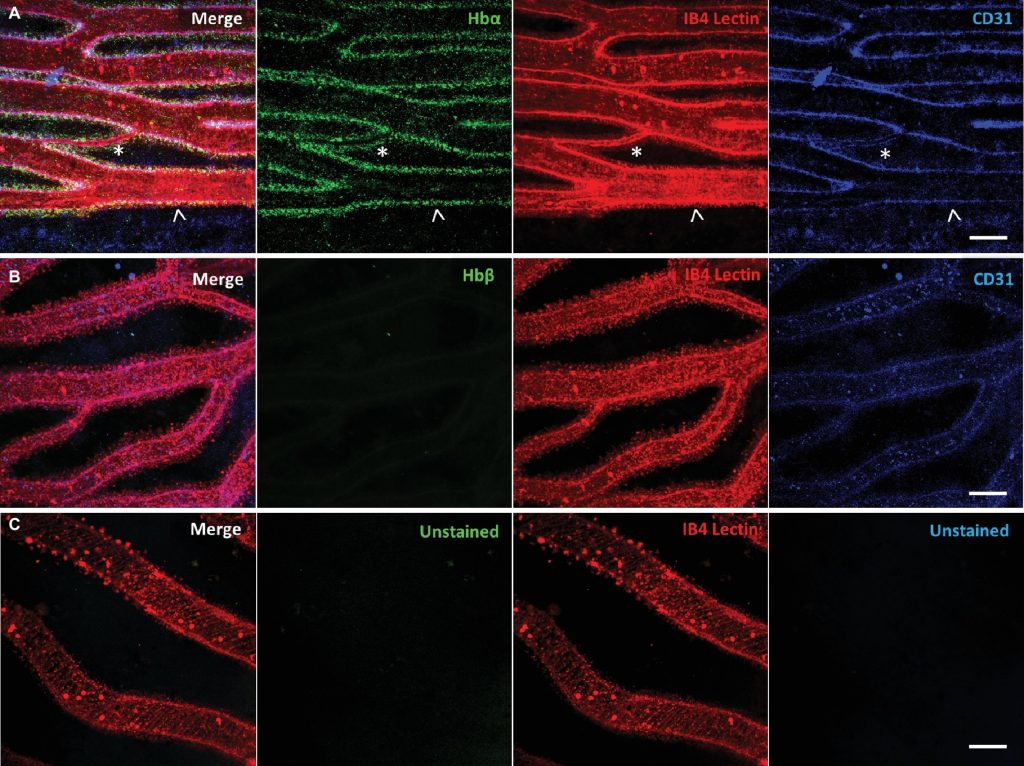
D’autres biologistes ont en revanche émis l’hypothèse que la perte de l’hémoglobine bêta, d’une grande partie de l’hémoglobine alpha, de la myoglobine et des globules rouges résulte de la pression de sélection du milieu aquatique de l’Antarctique qui est très pauvre en fer et seraient en fait une adaptation à cette contrainte plutôt qu’au froid! En effet, les globules rouges contiennent la grande majorité du fer de l’organisme dans l’hémoglobine. Étant donné que des niveaux plus faibles de globules rouges entrainent également une réduction des besoins en fer, ces biologistes proposent que cette réduction de globule rouge améliore ainsi le fitness. Ils proposent aussi que la séquence tronquée du gène codant pour l’hémoglobine alpha (qui ne peut lier l’oxygène) n’est pas un cas de pseudogénisation, contrairement à l’hémoglobine bêta et la myoglobine. En effet, en utilisant l’approche de « localiser » la courte protéine qui comporte une partie de la séquence de l’alpha-globine à l’aide d’immunohistochimie, ils ont déterminé qu’elle est toujours exprimée dans les vaisseaux sanguins de la rétine, ce qui n’est pas le cas de l’hémoglobine bêta (figure 22.10 A et B respectivement). Ce résultat pourrait, selon eux, démontrer une nouvelle fonction de l’hémoglobine alpha dans le développement et la fonction des capillaires [32]. Les poissons de glace n’ont pas fini de faire travailler les physiologistes!
7.2 Protéines structurantes de la glace chez les poissons de glace
L’océan antarctique où vivent les poissons de glace est à une température tout près de son point de congélation de -1,9 Celsius. Les physiologistes qui s’intéressent aux adaptations liées à la vie sous le point de congélation mesurent le point de fonte en laboratoire comme étant la température à laquelle les cristaux de glace commencent à apparaitre dans le sérum des poissons. Le point de congélation est la température où les cristaux se propagent. Habituellement il y a 1 centième ou 2 centièmes de degrés Celsius de différence entre ces deux valeurs chez un poisson. Ainsi, si le point de congélation du sérum d’un poisson osseux marin est de -0,8 Celsius, c’est aussi la valeur de son point de fonte. Les fluides des poissons ont donc un point de congélation en dessous de zéro, ce qui est dû principalement au chlorure de sodium, le principal soluté du sérum sanguin. Ce soluté est responsable de 85 % de la baisse du point de congélation jusqu’à -0,8 C. De plus, de petites quantités de potassium, de calcium, d’urée, de glucose et d’acides aminés libres contribuent à amener ce point de congélation à -0,8 C. Le sérum de certains poissons marins antarctiques contient plus de chlorure de sodium, ce qui fait baisser le point de congélation d’un autre 0,3 C comparativement aux poissons osseux marins en général. Cependant, ces adaptations physiologiques ne sont pas suffisantes pour survivre à -1,9 Celsius [33].
Chez les poissons de glace, il y a un écart d’au moins 1 degré Celsius entre le point de fonte et le point de congélation. Cela veut dire qu’un poisson qui se retrouve dans des conditions propices à la formation de cristaux dans son sérum (point de fonte), comme de l’eau à -1,9 degré Celsius, peut survivre, car les cristaux ne se propagent pas tant que la température ne descend pas d’un autre degré Celsius (point de congélation). Cet écart de 1 degré Celsius qui permet la survie des poissons de glace est le résultat de l’action des protéines structurantes de la glace. Ces protéines sont synthétisées dans le foie et forment 4 % du sérum. On les appelle parfois les « protéines anti-gel », car elles abaissent le point de congélation. Ce type de protéine structurante de la glace a d’ailleurs comme nom les « AFGP », l’acronyme pour Anti-freeze glycoproteins [33]. Ce sont les protéines structurantes de la glace qui abaissent le point de congélation des notothenioidei, ce qui leur permet de se servir de l’eau glacée comme un refuge et un habitat.
L’évolution des protéines structurantes de la glace permet de survivre mais crée un autre problème, car leur production représente une dépense énergétique significative. L’excrétion de ces protéines dans l’environnement serait couteuse et elles sont justement absentes de l’urine. Cela est dû au fait que les poissons de l’Antarctique qui supportent le gel ont des reins qui ne font pas de filtration, car ils n’ont pas de glomérules. Les glomérules sont une partie du néphron du rein qui est impliquée dans la filtration du sang. Comme les espèces proches qui n’ont pas de protéines structurantes de la glace ont des glomérules dans leur rein, cela suggère que les reins non fonctionnels représentent un autre cas d’évolution compensatoire qui est survenu à la suite de l’évolution des protéines structurantes de la glace et de leur synthèse couteuse.
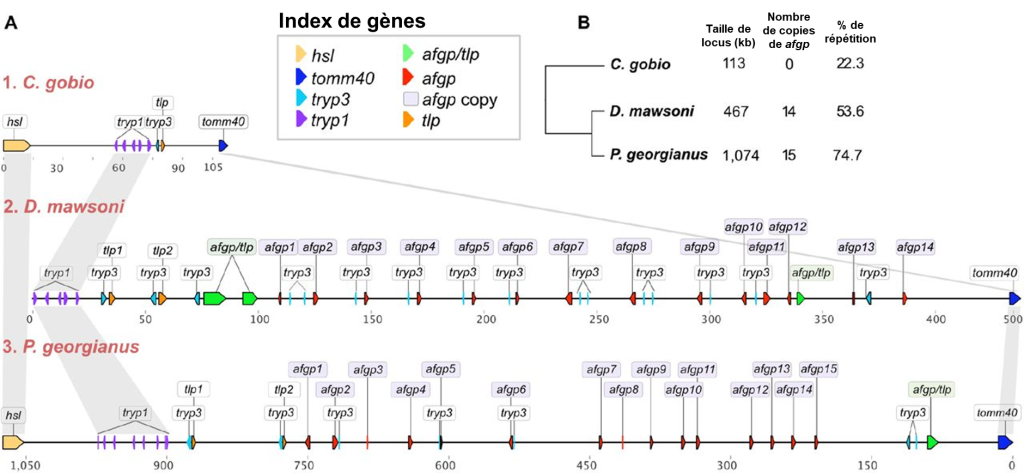
7.2.1 Évolution des protéines AGFP par duplication et néo-fonctionnalisation
Les protéines structurantes de la glace ont probablement évolué à la suite d’une duplication de gène suivi de l’évolution d’une nouvelle fonction, soit un cas de néo-fonctionnalisation, comme ce qu’on observe pour les opsines des humains. Christina Cheng et ses collègues ont étudié comment est apparu le gène qui code pour les protéines structurantes de la glace et comment il s’est ensuite dupliqué à répétition, ce qui a abouti à 8 protéines AGFP distinctes. Elle a proposé que le gène qui code pour ces protéines structurantes de la glace est dérivé d’un gène qui code pour une protéine trypsinogène, qui est la forme non active d’une enzyme digestive, la trypsine. L’équipe de recherche a proposé un scénario évolutif basé sur l’analyse des séquences d’ADN. Premièrement, il y a eu une duplication du gène codant pour un trypsinogène. Le génome comptait alors deux copies du gène. En plus des mutations dans la région codante originale du trypsinogène, une petite partie du gène qui va éventuellement coder pour la protéine structurante de la glace s’est ensuite amplifiée. Autrement dit, cette séquence est maintenant répétée. Les biologistes ont pu déduire cela en alignant le gène AFGP qui code pour les protéines structurantes de la glace et le gène qui code pour la protéine trypsinogène. Elles ont observé des régions qui sont très similaires de part et d’autre d’une séquence répétée qui n’existe que dans la protéine AFGP. Une autre mutation a aussi introduit un codon de terminaison (un « codon stop ») tôt dans la séquence, ce qui donne une protéine tronquée (plus courte), car la traduction de l’ARN messager en protéine s’arrête prématurément. Les biologistes qui ont fait cette étude ont estimé le moment où ces séquences ont divergé et ont proposé que les conditions dans l’océan à cette époque se sont considérablement refroidies, et qu’alors la nouvelle séquence qui a précédé l’évolution de celle de l’AFGP fonctionnelle n’était pas délétère pour l’individu, mais n’apportait pas de gain de fitness non plus. Selon ce scénario évolutif proposé, la protéine AGFP fonctionnelle comme protéine structurante de la glace est apparue dans la même période que le refroidissement de l’océan. Elle était alors probablement sécrétée uniquement par le pancréas (comme la protéine trypsinogène) et l’évolution subséquente a mené à sa duplication et son expression dans le foie, qui produit les AGFP qui circulent dans le sérum des poissons de glace. Récemment, ce groupe de recherche a comparé les génomes de plusieurs espèces de poissons de cette famille et a montré que toutes les espèces étudiées ont plusieurs copies du gène AGFP (figure 22.11) [34-36].
Entrevue avec la professeure Christina Cheng
University of Illinois. (2008). Antarctic Fish [Vidéo]. Youtube. https://youtu.be/VbqHQss1SSg
7.2.2 Évolution convergente des protéines structurantes de la glace chez les poissons
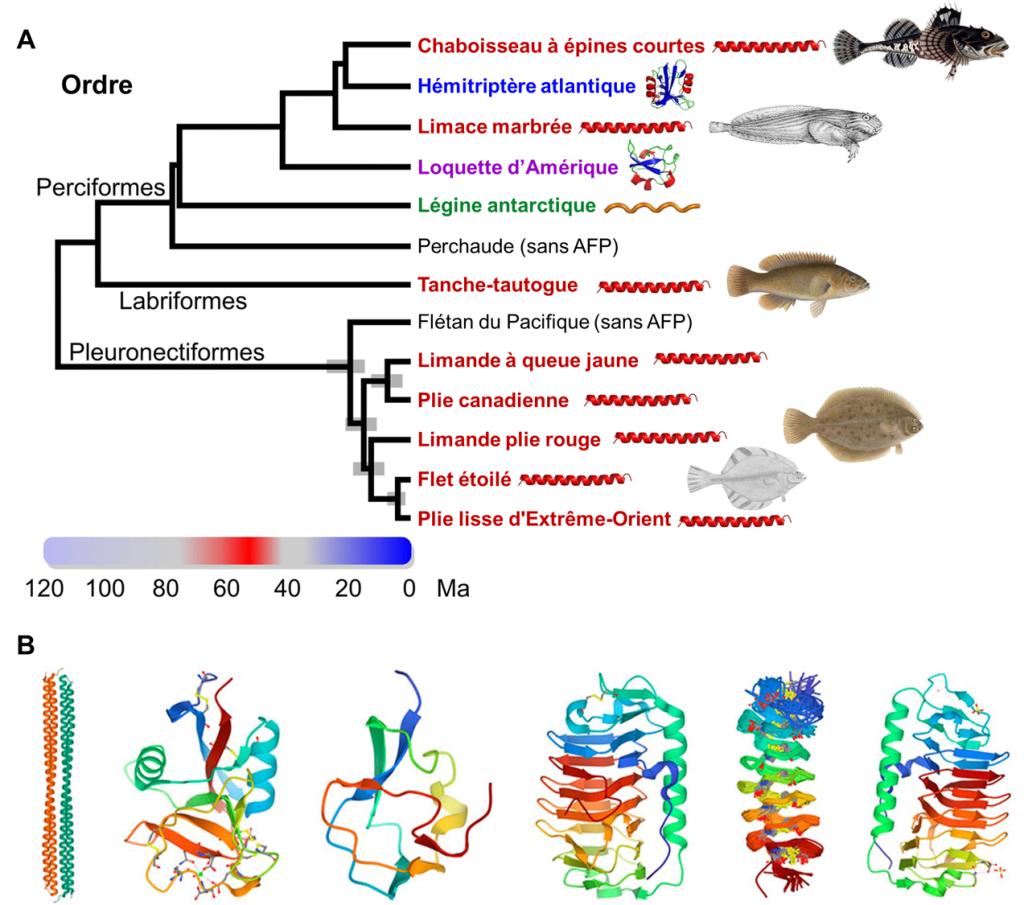
Des biologistes évolutifs ont démontré que plusieurs ordres de poissons expriment des protéines structurantes de la glace. Diverses molécules sont impliquées comme ayant des fonctions « anti-gel » selon l’espèce de poissons étudiée. Si on analyse un arbre phylogénétique simplifié qui représente les ordres de poissons, on peut voir deux ordres où on retrouve des protéines structurantes de la glace (AGFP) : chez les gadiformes, qui incluent les morues, et chez les notothenioidés, qui incluent les poissons de glace (figure 22.12). Nous pouvons proposer deux hypothèses en analysant cet arbre. La première est que la protéine AGFP a évolué dans l’ancêtre des morues et de tous les autres poissons osseux et a ensuite été perdue dans toutes les espèces sauf certains poissons de glace et l’ordre des morues. La deuxième hypothèse que l’on peut faire en regardant cet arbre, c’est que les protéines AGFP ont évolué indépendamment plusieurs fois chez les poissons. Ce serait alors un exemple d’évolution convergente. L’hypothèse la plus parcimonieuse, soit celle qui nécessite le moins de changements évolutifs, est celle qui doit être favorisée. Dans ce cas-ci, il est plus parcimonieux de choisir la deuxième hypothèse qui nécessite l’évolution du trait seulement 2 fois, plutôt que l’hypothèse qui suppose que le trait a été perdu des milliers de fois.
Les études les plus récentes utilisant les données sur les génomes des poissons suggèrent que les protéines antigels peuvent être classées en 4 groupes (I, II, III et AGFP) et qu’à l’intérieur de chaque type, elles ont évolué de façon indépendante au moins 4 fois chez les poissons. En plus des AGFP des morues et des poissons de glace, on retrouve par exemple des protéines antigels de type « I » chez les labroidei, les scorpaeniformes et les pleuronectiformes (figure 22.12) [37, 38].
7.2.3 Évolution de gène de novo
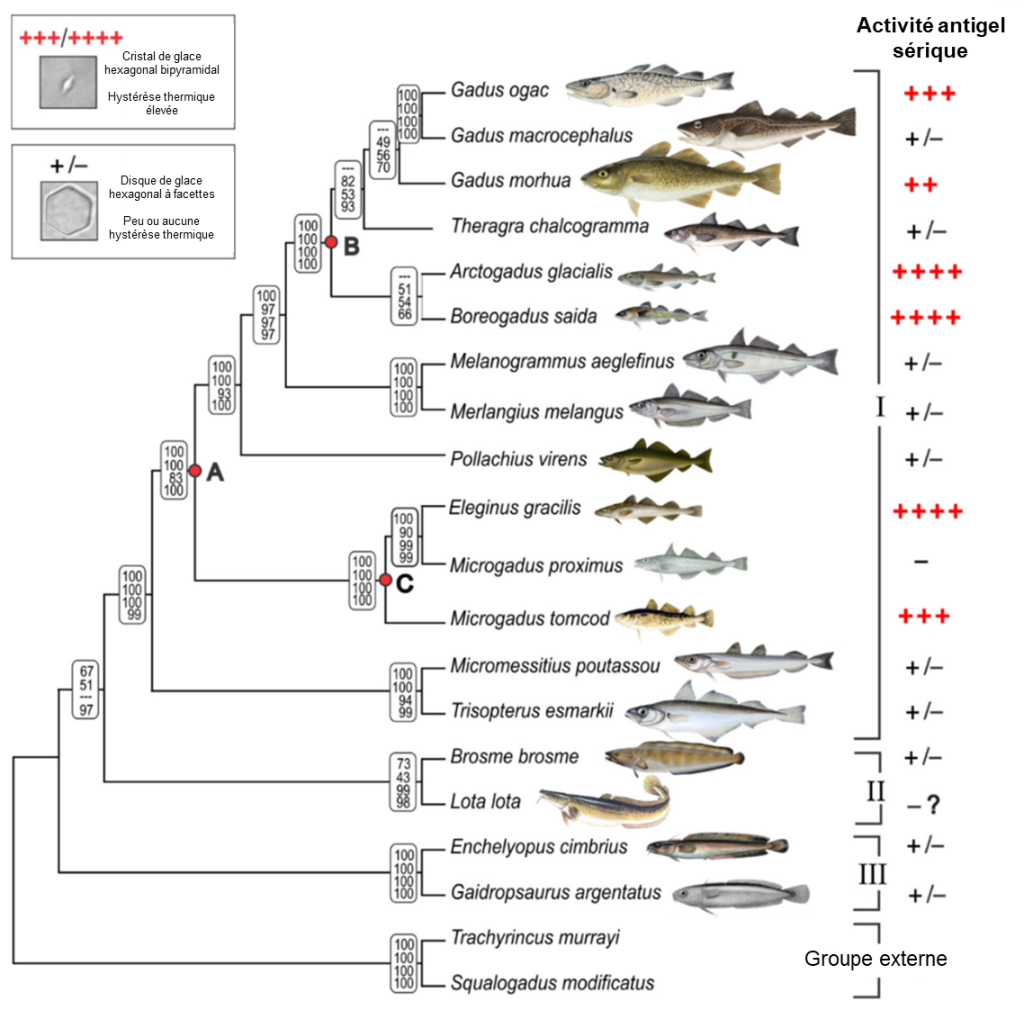
Une fois que la présence de protéines structurantes de la glace fut connue pour plusieurs ordres de poisson et qu’il semblait que ce soit le résultat de l’évolution convergente, des biologistes ont tenté de déterminer si le même gène de la trypsine a évolué par duplication et divergence et résulté en une protéine structurante de la glace chez les morues. Mené par Helle Baalstrud, ce groupe de biologistes a séquencé le génome de plusieurs notothenioides qui ont des protéines antigel ou non et ont utilisé les données publiques sur les génomes de 25 gadiformes (ordre auquel appartiennent les morues) pour les comparer (figure 22.13). Cette étude n’a pas trouvé de trace d’un gène similaire à celui des poissons de glace. Ils ont bien trouvé un gène qui code pour une protéine structurante de la glace qui agit de la même façon que celle des poissons de glace (tel qu’on peut le voir dans l’analyse de son activité dans la figure 22.13), mais celle-ci a une origine évolutive entièrement différente. Leur analyse a démontré que les gènes qui codent pour les protéines structurantes de la glace dans cet ordre des gadiformes sont en fait des gènes avec de nouvelles fonctions qui ont évolué « de novo », c’est-à-dire à partir d’une séquence qui ne codait pour rien de fonctionnel [42].
Toutes les protéines qui existent sur terre ont un ancêtre qui a originellement évolué de novo, au début de la vie. Cependant, jusqu’à la fin du 20e siècle, la plupart des biologistes évolutifs s’entendaient pour dire que la probabilité que des mutations s’accumulent assez et dans le bon ordre pour donner une séquence codant pour un peptide fonctionnel qui serait sélectionné était pratiquement nulle et donc que les gènes de novo devaient être une exception évolutive, par exemple comparativement à la probabilité qu’une mutation change la séquence d’une protéine existante. Cependant, depuis les 25-30 dernières années, les exemples d’évolution de gènes de novo se sont accumulés. Des analyses bioinformatiques suggèrent même que plus de la moitié des gènes qui sont orphelins, c’est-à-dire un gène qu’on étudie dans une espèce et pour lequel on ne peut trouver une séquence similaire dans une autre espèce, seraient potentiellement des gènes qui sont apparus de novo, plutôt que le résultat d’une divergence de séquence si rapide et complète qu’on ne retrouve plus le paralogue ou l’orthologue [43].
Aubin-Horth, N. (2024). Écophysiologie évolutive: les gènes de novo. [Vidéo]. Youtube. CC-BY. https://youtu.be/TH7gELENjKo?si=a7RH3_YwzmSOvMpV
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien: Transcription_chapitre22
Cas appliqué
Texte adapté de [44].
Des biologistes se sont intéressés aux courbes de performance thermiques d’espèces de lézards de l’Amazonie. Ils étaient intéressés à caractériser la diversité de ces courbes entre les espèces et à prédire si ces espèces seraient plus ou moins affectées par les changements climatiques selon leur habitat préférentiel (habitat ouvert ou forestier). Ils ont étudié des espèces provenant de 11 familles retrouvées en Amazonie (figure 22.14). Ils ont capturé des individus sauvages et ont effectué des mesures en captivité sur quelques jours avant de les relâcher à leur site d’origine. Ils n’ont donc pas pris en compte la possibilité d’acclimatation, les effets de sexe, de gravidité, d’infection ou de plasticité du développement.
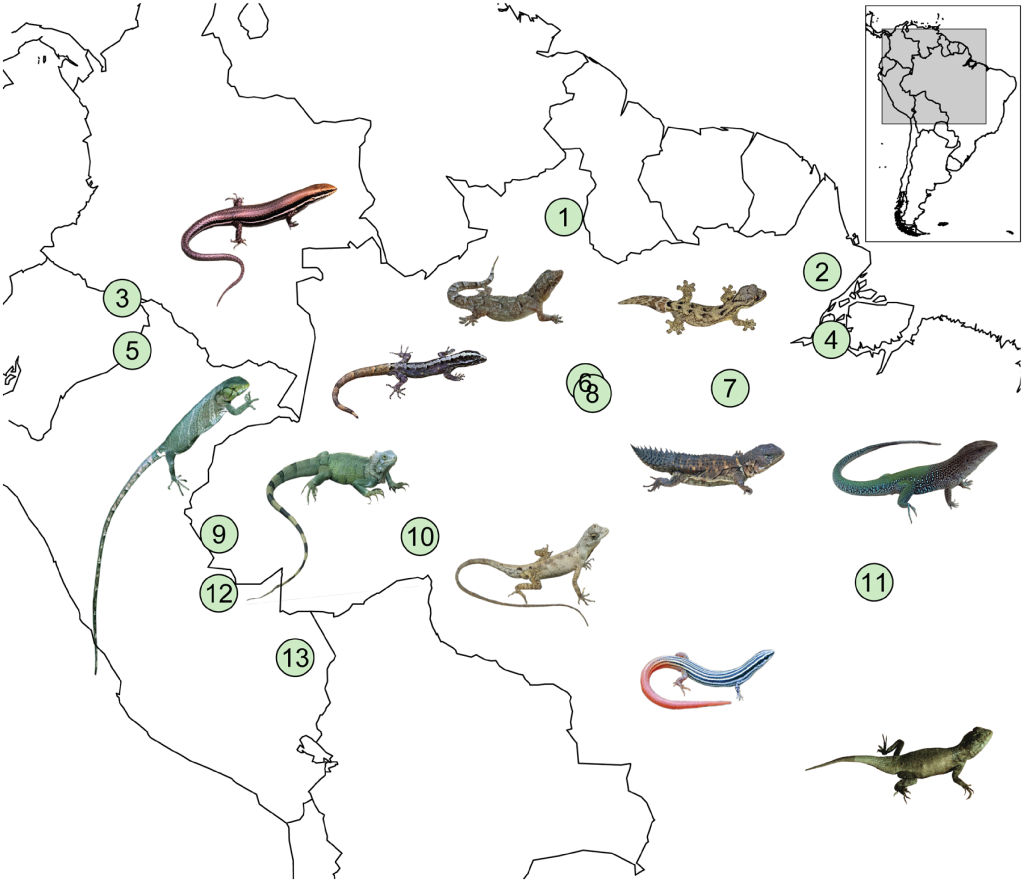
Les biologistes ont mesuré les températures critiques sur 485 individus de 26 espèces. Ils ont augmenté ou diminué la température corporelle d’un individu dans une chambre refroidie par des blocs de glace ou chauffée par de l’eau chaude jusqu’à ce que l’animal perde sa réaction de redressement et perde l’équilibre. Chaque animal a été testé à la fois pour CTmin et CTmax, et chauffé/refroidi à sa température préférée (déterminée préalablement dans un test de choix de température) immédiatement après les tests. Ils ont calculé la température optimale (Topt), avec des expériences de capacité locomotrice sur 254 individus. Ils ont stimulé chaque individu à courir une fois à des températures assignées au hasard (15 ̊, 20 ̊, 25 ̊, 30 ̊, 35 ̊, 40 ̊ et 43 ̊C). Pour mesurer les performances à chaque température, la personne expérimentatrice a poussé manuellement les lézards pour qu’ils courent autour d’une piste circulaire jusqu’à l’épuisement, mesuré par l’incapacité à se redresser lorsque placés en position couchée. La performance des animaux a été calculée comme la distance volontaire parcourue sur la piste. La température optimale (Topt) a été estimée comme la température corporelle qui donnait la valeur la plus élevée de performance locomotrice, en se basant sur les courbes de performance thermique.La valeur de CTmax mesurée pour 10 espèces allait de 40 à 50 Celsius. La valeur de température optimale à laquelle la performance locomotrice était la plus élevée variait entre les espèces, allant de 25,8 Celsius à 34, 5 Celsius (figure 22.15).
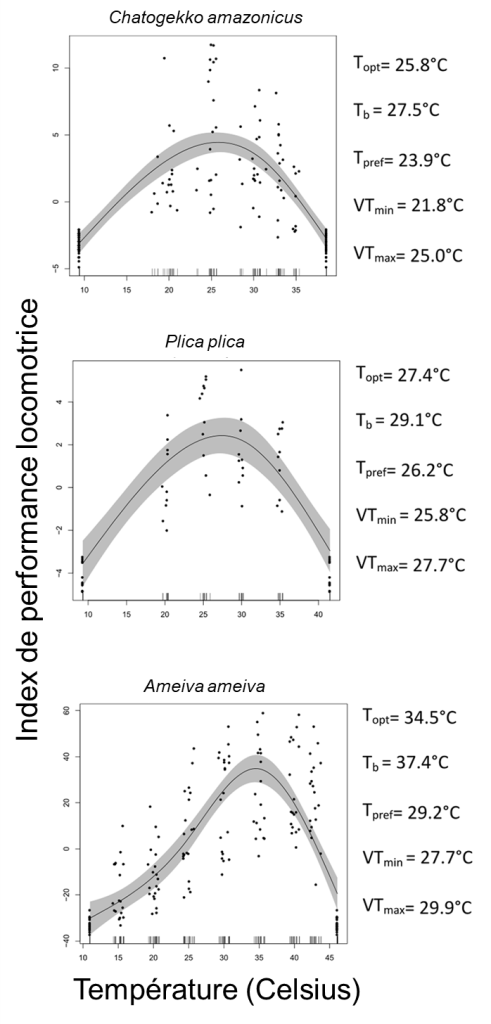
En se basant sur leurs connaissances de l’habitat des différentes espèces, les physiologistes ont constaté que les espèces utilisant des habitats ouverts ont une bonne performance dans les conditions environnementales actuelles. Pour les lézards forestiers, ils prédisent par contre que les tendances au réchauffement en Amazonie induiront un stress thermique, car les températures prévues dépasseront les tolérances thermiques mesurées pour ces espèces.
Résumé
Il existe différentes réponses utilisées dans le monde du vivant face aux défis que présente la gamme de températures rencontrées sur terre. Les physiologistes étudient la performance thermique des animaux en laboratoire à l’aide de différentes mesures, ce qui leur permet de déterminer une température critique minimale et maximale. Il existe plusieurs réponses cellulaires face au gel, incluant la production de cryoprotecteurs. Les poissons de glace en Antarctique montrent de nombreux traits divergents, certains étant peut-être le résultat de la sélection naturelle et d’autres de l’évolution compensatoire, à la suite de l’évolution de ces traits. Les protéines structurantes de la glace sont un de ces traits qui permet de survivre à des températures océaniques de -1,9 Celsius que l’on retrouve chez les Channichthyidae. Ces protéines ont évolué par duplication et néo-fonctionnalisation d’un gène codant à l’origine pour un trypsinogène sécrétée par le pancréas. Ce type de protéine « anti-gel » agissant sur le point de congélation du sérum et du liquide extracellulaire a évolué de façon répétée chez plusieurs grands groupes de poissons, incluant par évolution d’un gène de novo chez les gadiformes, dont font partie les morues.
Activité de révision
Exercices
Révision sur l’évolution de la réponse à la température
Bibliographie
- Contributeurs à Wikipedia (2023). Loi d’Arrhenius, in Wikipédia, l’encyclopédie libre. https://fr.wikipedia.org/w/index.php?title=Sp%C3%A9cial:Citer&page=Loi_d%27Arrhenius&id=207912277&wpFormIdentifier=titleform.
- Hinic-Frlog, S. (2019). Limits of Life, in Introductory Animal Physiology [CC-BY]. https://ecampusontario.pressbooks.pub/animalphysiology/chapter/1-2/.
- Wikipedia contributors (2024). Thermoregulation, in Wikipedia, The Free Encyclopedia [CC-BY-SA]. https://en.wikipedia.org/wiki/Thermoregulation.
- Hannah, R. and E. Joo (2022). Example of Homeostasis: Thermoregulation, in Animal Physiology [CC0]. University of Alaska Anchorage. https://ua.pressbooks.pub/animalphysiology/chapter/example-of-homeostasis-thermoregulation/.
- The Open University (2019). A side-blotched lizard (Uta stansburiana) basking in the Sun [CC-BY-NC-SA]. https://www.open.edu/openlearn/mod/oucontent/view.php?id=18463§ion=2.3#back_thumbnailfigure_idm128.
- Croak, B.M., M.S. Crowther, J.K. Webb, and R. Shine (2013). Movements and Habitat Use of an Endangered Snake, Hoplocephalus bungaroides (Elapidae): Implications for Conservation [CC-BY]. PLOS ONE. 8(4): p. e61711. https://doi.org/10.1371/journal.pone.0061711.
- Rabosky, A.R.D., A. Corl, H.E.M. Liwanag, Y. Surget-Groba, and B. Sinervo (2012). Direct Fitness Correlates and Thermal Consequences of Facultative Aggregation in a Desert Lizard [CC-BY]. PLOS ONE. 7(7): p. e40866. https://doi.org/10.1371/journal.pone.0040866.
- Schulte, P.M., T.M. Healy, and N.A. Fangue (2011). Thermal Performance Curves, Phenotypic Plasticity, and the Time Scales of Temperature Exposure Integrative and Comparative Biology. 51(5): p. 691-702. https://doi.org/10.1093/icb/icr097.
- Desforges, J.E., K. Birnie-Gauvin, F. Jutfelt, K.M. Gilmour, E.J. Eliason, T.L. Dressler, D.J. McKenzie, A.E. Bates, M.J. Lawrence, N. Fangue, and S.J. Cooke (2023). The ecological relevance of critical thermal maxima methodology for fishes J Fish Biol. 102(5): p. 1000-1016.
- Wooliver, R., E.E. Vtipilthorpe, A.M. Wiegmann, and S.N. Sheth (2022). A viewpoint on ecological and evolutionary study of plant thermal performance curves in a warming world [CC-BY]. AoB PLANTS. 14(3): p. plac016. https://doi.org/10.1093/aobpla/plac016.
- Sinclair, B.J., K.E. Marshall, M.A. Sewell, D.L. Levesque, C.S. Willett, S. Slotsbo, Y. Dong, C.D. Harley, D.J. Marshall, B.S. Helmuth, and R.B. Huey (2016). Can we predict ectotherm responses to climate change using thermal performance curves and body temperatures? Ecol Lett. 19(11): p. 1372-1385.
- Katzenberger, M., J. Hammond, H. Duarte, M. Tejedo, C. Calabuig, and R.A. Relyea (2014). Swimming with Predators and Pesticides: How Environmental Stressors Affect the Thermal Physiology of Tadpoles [CC-BY]. PLOS ONE. 9(5): p. e98265. https://doi.org/10.1371/journal.pone.0098265.
- Robichaud, J.A., G. Bulté, H.A. MacMillan, and S.J. Cooke (2022). Five months under ice: biologging reveals behaviour patterns of overwintering freshwater turtles Canadian Journal of Zoology. 101(3): p. 152-162. https://doi.org/10.1139/cjz-2022-0100.
- Paplanus, P. (2017). Common Map Turtle (Graptemys geographica), in Flickr [CC-BY]. https://www.flickr.com/photos/2ndpeter/36510522160/.
- Hengherr, S., M.R. Worland, A. Reuner, F. Brümmer, and R.O. Schill (2009). Freeze tolerance, supercooling points and ice formation: comparative studies on the subzero temperature survival of limno-terrestrial tardigrades Journal of Experimental Biology. 212(6): p. 802-807. https://doi.org/10.1242/jeb.025973.
- Contributeurs à Wikipedia (2023). Surfusion, in Wikipédia, l’encyclopédie libre [CC-BY-SA]. https://fr.wikipedia.org/wiki/Surfusion.
- Lubawy, J., S. Chowański, Z. Adamski, and M. Słocińska (2022). Mitochondria as a target and central hub of energy division during cold stress in insects Frontiers in Zoology. 19(1): p. 1. https://doi.org/10.1186/s12983-021-00448-3.
- Shekhovtsov, S.V., N.A. Bulakhova, Y.P. Tsentalovich, E.A. Zelentsova, E.N. Meshcheryakova, T.V. Poluboyarova, and D.I. Berman (2022). Metabolomic Analysis Reveals That the Moor Frog Rana arvalis Uses Both Glucose and Glycerol as Cryoprotectants [CC-BY]. Animals. 12(10): p. 1286. https://www.mdpi.com/2076-2615/12/10/1286.
- Storey, K.B. and J.M. Storey (2017). Molecular Physiology of Freeze Tolerance in Vertebrates Physiological Reviews. 97(2): p. 623-665. https://doi.org/10.1152/physrev.00016.2016.
- Toxopeus, J. and B.J. Sinclair (2018). Mechanisms underlying insect freeze tolerance Biological Reviews. 93(4): p. 1891-1914. https://doi.org/10.1111/brv.12425.
- Bredow, M. and V.K. Walker (2017). Ice-Binding Proteins in Plants Frontiers in Plant Science. 8. https://www.frontiersin.org/articles/10.3389/fpls.2017.02153.
- Goodsell, D.S. (2009). Antifreeze Proteins, in RCSB PDB [CC-BY]. https://pdb101.rcsb.org/motm/120.
- Box, I.C.H., B.J. Matthews, and K.E. Marshall (2022). Molecular evidence of intertidal habitats selecting for repeated ice-binding protein evolution in invertebrates J Exp Biol. 225(Suppl_1).
- Iliana, B., M.D.W. Jonathan, D. Thomas, A.M. Shane, M. Michael, N. Zemin, T. Alan, T. James, S. Ying, C. William, S. Michelle, O. Karen, H. Leanne, S. Walter, H.P. John, H. Kerstin, S.C. Melody, H.D. William, III, C.H.C. Cheng, A.M. Eric, and D. Richard (2022). Genomics of cold adaptations in the Antarctic notothenioid fish radiation [CC-BY]. bioRxiv: p. 2022.06.08.494096. http://biorxiv.org/content/early/2022/06/09/2022.06.08.494096.abstract.
- Kim, B.-M., A. Amores, S. Kang, D.-H. Ahn, J.-H. Kim, I.-C. Kim, J.H. Lee, S.G. Lee, H. Lee, J. Lee, H.-W. Kim, T. Desvignes, P. Batzel, J. Sydes, T. Titus, C.A. Wilson, J.M. Catchen, W.C. Warren, M. Schartl, H.W. Detrich, J.H. Postlethwait, and H. Park (2019). Antarctic blackfin icefish genome reveals adaptations to extreme environments [CC-BY]. Nature Ecology & Evolution. 3(3): p. 469-478. https://doi.org/10.1038/s41559-019-0812-7.
- Brandonortizc (2019). Antarctic Fish [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:ANTARTIC_FISH.png.
- Eastman, J.T. and A.L. Devries (1986). Renal glomerular evolution in Antarctic notothenioid fishes Journal of Fish Biology. 29(6): p. 649-662. https://doi.org/10.1111/j.1095-8649.1986.tb04981.x.
- Near, T.J., S.K. Parker, and H.W. Detrich, 3rd (2006). A genomic fossil reveals key steps in hemoglobin loss by the antarctic icefishes Mol Biol Evol. 23(11): p. 2008-16.
- Sidell, B.D. and K.M. O’Brien (2006). When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes Journal of Experimental Biology. 209(10): p. 1791-1802. https://doi.org/10.1242/jeb.02091.
- Desvignes, T., I. Bista, K. Herrera, A. Landes, and J.H. Postlethwait (2023). Cold-Driven Hemoglobin Evolution in Antarctic Notothenioid Fishes Prior to Hemoglobin Gene Loss in White-Blooded Icefishes [CC-BY-NC]. Molecular Biology and Evolution. 40(11): p. msad236. https://doi.org/10.1093/molbev/msad236.
- Harter, T.S., M.A. Sackville, J.M. Wilson, D.C.H. Metzger, S. Egginton, A.J. Esbaugh, A.P. Farrell, and C.J. Brauner (2018). A solution to Nature’s haemoglobin knockout: a plasma-accessible carbonic anhydrase catalyses CO(2) excretion in Antarctic icefish gills J Exp Biol. 221(Pt 22).
- Corliss, B.A., L.J. Delalio, T.C. Stevenson Keller, A.S. Keller, D.A. Keller, B.H. Corliss, J.M. Beers, S.M. Peirce, and B.E. Isakson (2019). Vascular Expression of Hemoglobin Alpha in Antarctic Icefish Supports Iron Limitation as Novel Evolutionary Driver [CC-BY]. Frontiers in Physiology. 10. https://www.frontiersin.org/articles/10.3389/fphys.2019.01389.
- DeVries, A.L. (1988). The role of antifreeze glycopeptides and peptides in the freezing avoidance of antarctic fishes Comparative Biochemistry and Physiology Part B: Comparative Biochemistry. 90(3): p. 611-621. https://www.sciencedirect.com/science/article/pii/0305049188903021.
- Hsiao, K.C., C.H. Cheng, I.E. Fernandes, H.W. Detrich, and A.L. DeVries (1990). An antifreeze glycopeptide gene from the antarctic cod Notothenia coriiceps neglecta encodes a polyprotein of high peptide copy number Proc Natl Acad Sci U S A. 87(23): p. 9265-9.
- Rivera-Colón, A.G., N. Rayamajhi, B.F. Minhas, G. Madrigal, K.T. Bilyk, V. Yoon, M. Hüne, S. Gregory, C.H.C. Cheng, and J.M. Catchen (2023). Genomics of Secondarily Temperate Adaptation in the Only Non-Antarctic Icefish Molecular Biology and Evolution. 40(3): p. msad029. https://doi.org/10.1093/molbev/msad029.
- Chen, L., A.L. DeVries, and C.H. Cheng (1997). Evolution of antifreeze glycoprotein gene from a trypsinogen gene in Antarctic notothenioid fish Proc Natl Acad Sci U S A. 94(8): p. 3811-6.
- Chen, L., A.L. DeVries, and C.H. Cheng (1997). Convergent evolution of antifreeze glycoproteins in Antarctic notothenioid fish and Arctic cod Proceedings of the National Academy of Sciences. 94(8): p. 3817-3822. https://doi.org/10.1073/pnas.94.8.3817.
- Graham, L.A., R.S. Hobbs, G.L. Fletcher, and P.L. Davies (2013). Helical Antifreeze Proteins Have Independently Evolved in Fishes on Four Occasions PLOS ONE. 8(12): p. e81285. https://doi.org/10.1371/journal.pone.0081285.
- Graham, L.A., S.Y. Gauthier, and P.L. Davies (2022). Origin of an antifreeze protein gene in response to Cenozoic climate change [CC-BY]. Scientific Reports. 12(1): p. 8536. https://doi.org/10.1038/s41598-022-12446-4.
- Gharib, G., S. Saeidiharzand, A.K. Sadaghiani, and A. Koşar (2022). Antifreeze Proteins: A Tale of Evolution From Origin to Energy Applications [CC-BY]. Frontiers in Bioengineering and Biotechnology. 9. https://www.frontiersin.org/articles/10.3389/fbioe.2021.770588.
- Zhuang, X. and C.-H.C. Cheng (2021). Propagation of a De Novo Gene under Natural Selection: Antifreeze Glycoprotein Genes and Their Evolutionary History in Codfishes [CC-BY]. Genes. 12(11): p. 1777. https://www.mdpi.com/2073-4425/12/11/1777.
- Baalsrud, H.T., O.K. Tørresen, M.H. Solbakken, W. Salzburger, R. Hanel, K.S. Jakobsen, and S. Jentoft (2017). De Novo Gene Evolution of Antifreeze Glycoproteins in Codfishes Revealed by Whole Genome Sequence Data Molecular Biology and Evolution. 35(3): p. 593-606. https://doi.org/10.1093/molbev/msx311.
- Vakirlis, N., A.-R. Carvunis, and A. McLysaght (2020). Synteny-based analyses indicate that sequence divergence is not the main source of orphan genes eLife. 9: p. e53500. https://doi.org/10.7554/eLife.53500.
- Diele-Viegas, L.M., L.J. Vitt, B. Sinervo, G.R. Colli, F.P. Werneck, D.B. Miles, W.E. Magnusson, J.C. Santos, C.M. Sette, G.H.O. Caetano, E. Pontes, and T.C.S. Ávila-Pires (2018). Thermal physiology of Amazonian lizards (Reptilia: Squamata) [CC-BY]. PLOS ONE. 13(3): p. e0192834. https://doi.org/10.1371/journal.pone.0192834.

