12. Les rythmes biologiques
Introduction au sujet
Dans ce chapitre, nous allons parler d’un deuxième sujet qui démontre comment la physiologie constitue l’interface entre l’environnement et l’organisme. Pour ce faire, nous allons en apprendre plus sur les rythmes biologiques, comment on les étudie et comment certains sont sous le contrôle endogène d’un mécanisme moléculaire qu’on appelle l’horloge biologique. On va voir comment ces horloges biologiques ont été étudiées, comment elles fonctionnent et comment elles sont connectées à l’environnement externe et au système hormonal à travers la mélatonine. Nous allons aussi nous questionner sur la valeur adaptative des rythmes biologiques en étudiant directement l’avantage pour la performance et le fitness d’avoir une horloge biologique fonctionnelle.
Objectifs spécifiques
À la fin de ce chapitre, vous serez en mesure de :
- Connaitre les caractéristiques des différents types de rythmes biologiques étudiés en chronobiologie
- Expliquer comment on représente visuellement un rythme biologique
- Expliquer le concept d’origine endogène de plusieurs rythmes biologiques
- Définir la période en libre cours
- Connaitre ce qu’est un rythme en phase et l’entrainement
- Connaitre ce qu’est un zeitgeber
- Connaitre la fonction du noyau suprachiasmatique des mammifères
- Expliquer le fonctionnement de l’horloge biologique au niveau moléculaire
- Expliquer les méthodes permettant d’étudier l’horloge biologique moléculaire
- Expliquer les deux voies par lesquelles le NSC agit sur l’organisme
- Expliquer les effets de l’horloge du NSC sur les horloges périphériques
- Expliquer le lien entre les cellules du NSC et l’épiphyse
- Expliquer la relation entre le zeitgeber et l’activité de la mélatonine
- Expliquer les bases hormonales du phénomène de photopériodisme
- Tester que les rythmes biologiques sont une adaptation
- Expliquer l’importance pour la performance et le fitness de la capacité d’anticipation que procure l’horloge
Notions clés
- Les rythmes biologiques
- La représentation visuelle des rythmes biologiques
- Le contrôle des rythmes biologiques
- Les rythmes endogènes
- La période en libre cours
- L’entrainement d’un rythme par une variable environnementale
- Les zeitgebers
- L’horloge biologique
- L’horloge biologique des mammifères et le noyau suprachiasmatique
- Fonctionnement de l’horloge biologique
- Étudier l’horloge biologique au niveau moléculaire
- L’horloge biologique du NSC transmet son message au reste du corps par deux voies
- Les effets des cellules du NSC sur les horloges périphériques
- Les effets des cellules du NSC sur l’épiphyse
- Le rôle de la mélatonine
- Le photopériodisme
- Est-ce que les rythmes biologiques sont une adaptation?
- La capacité d’anticipation liée à l’horloge biologique
1. Les rythmes biologiques
Les êtres vivants vivent dans un environnement périodique :
- Cycle de lumière
- Température
- Marées
- Saisons
On peut observer des rythmes biologiques chez de nombreuses espèces. Si on pense à nous même, les humains, le cycle de sommeil et d’éveil est un bon exemple. De nombreuses espèces ont un rythme annuel de migration, d’hibernation ou d’estivation, par exemple chez de nombreux vertébrés et des insectes. La reproduction suit aussi souvent un rythme annuel, par exemple chez les plantes ou les champignons vivant en milieu tempéré.
Cette courte vidéo présente l’ensemble des sujets dont nous discuterons dans ce chapitre en utilisant les plantes comme exemple. Vous pouvez la regarder avant de lire le chapitre et la revisionner après avoir appris toutes les notions sur les rythmes biologiques, pour comparer tout ce que vous avez compris la deuxième fois!
Comment les plantes lisent l’heure
TED-Ed. (2015). How plants tell time – Dasha Savage [Vidéo]. Youtube. https://www.youtube.com/watch?v=3jIW5wW2WC0&ab_channel=TED-Ed
L’étude des rythmes biologiques s’appelle la chronobiologie. Les rythmes étudiés en chronobiologie sont des évènements récurrents caractérisés par (figure 12.1) :
- Une période : temps requis pour compléter un cycle
- Une amplitude : différence entre un extrême et la valeur moyenne
- Une fréquence : nombre de cycles complétés par unité de temps
- Une phase : moment dans le rythme par rapport à un évènement externe (ex. : lever du soleil)
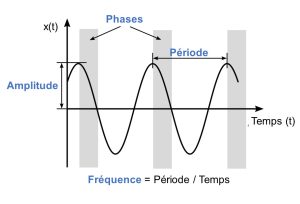
La chronobiologie étudie toutes sortes de rythmes, mais le plus souvent les recherches s’intéressent aux rythmes circadiens. Ces rythmes ont une période d’environ 24 heures (22-26h), car circa veut dire proche et dien veut dire jour. La fréquence de ce rythme est donc de 1 fois sur une période de 24 heures (figure 12.2). Nous verrons à la prochaine section que pour les scientifiques qui travaillent en chronobiologie, un rythme peut être appelé un rythme circadien seulement s’il est contrôlé de façon endogène, c’est-à-dire que le rythme continue à avoir une période d’environ 24 heures même en absence d’information de l’environnement.
2. La représentation visuelle des rythmes biologiques
En général, pour étudier les rythmes biologiques, les chronobiologistes font des mesures en continu dans le temps sur une période d’au moins 24 heures, souvent pour plusieurs jours consécutifs. Les variables mesurées peuvent être un comportement ou un trait physiologique, cellulaire ou moléculaire. Afin de produire une représentation visuelle de ces données, on les projette dans un graphique où la valeur du trait mesuré est sur l’axe des y et le temps sur l’axe des x. On utilise généralement deux types de représentation visuelle des données en chronobiologie, soit l’actogramme et le « strip-chart ». Dans les deux cas, on mesure les caractéristiques du rythme.
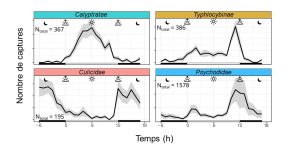
Un actogramme permet de quantifier par exemple l’activité locomotrice, l’alimentation, ou la vocalisation. C’est un graphique simple où chaque « événement » (mouvement, prise alimentaire, vocalisation) est représenté comme une barre verticale sur le graphique. Le graphique comprend une section qui montre si la lumière était présente ou non avec une barre horizontale blanche ou noire (figure 12.3A). Un strip-chart permet de faire une représentation de la valeur d’un trait, incluant d’un trait physiologique qui n’est pas divisible en « événements », (la température du corps ou le niveau d’une hormone par exemple) en fonction du temps (figure 12.3B). On peut aussi ajouter une barre au-dessus du graphique représentant la présence ou l’absence de lumière (voir par exemple la figure 12.2).
3. Le contrôle des rythmes biologiques
Dans certains cas, les rythmes biologiques peuvent être régulés uniquement par des conditions de l’environnement, par exemple, l’alternance entre le jour et la nuit. Dans ce cas, si on enlève la source environnementale (par exemple, le changement dans la luminosité), le rythme disparait. À l’opposé, d’autres rythmes gardent leur période même si on isole l’organisme de toute variation environnementale. Ce sont ces rythmes endogènes auxquels nous nous attarderons maintenant.
3.1. Les rythmes endogènes
Déjà au 18e siècle, le biologiste Jacques de Mairan avait fait une expérience montrant qu’un rythme biologique pouvait continuer de se produire en absence complète de lumière. Il a utilisé une plante caractérisée par le mouvement de ses feuilles entre le jour et la nuit (figure 12.4 et vidéo).

Un exemple de plante qui a un rythme de mouvement de ses feuilles.
Jasper124c41. (2009). Cucumber Nyctinasty 2 [Vidéo]. Youtube. https://www.youtube.com/watch?v=_qu09TKSNso&ab_channel=Jasper124c41
Il a placé une de ces plantes dans un milieu fermé où la lumière ne pouvait se rendre et une autre à la lumière du jour. Il a ensuite comparé le rythme du mouvement des feuilles. Grâce à cette manipulation expérimentale, on peut avoir une idée des causes proximales de ce mouvement des feuilles, c’est-à-dire le mécanisme qui mène au phénotype qui nous intéresse. Cette expérience nous apprend en effet que ce rythme biologique est contrôlé par un mécanisme endogène de mesure du temps, c’est-à-dire un rythme qui continue en absence d’information environnementale (endo-gène, ça veut dire « généré de l’intérieur »). C’est la définition de rythme endogène. Nous allons voir que, bien que les rythmes endogènes aient la caractéristique d’être présents sans signal de l’environnement, ils peuvent aussi être synchronisés avec l’environnement.
3.2 La période en libre cours
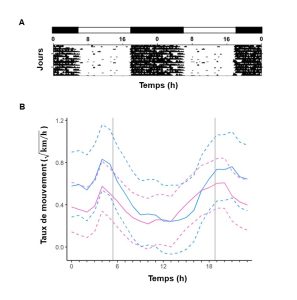
Nous avons vu que la période est le temps nécessaire pour compléter un cycle. Pour les rythmes endogènes, on peut quantifier la période interne de l’animal lorsqu’elle n’est pas affectée par les conditions environnementales, ce qu’on nomme la « période en libre cours ». Cette période est constante pour un individu, mais pas précisément de 24 heures. Pour quantifier cette période, il faut bien sûr éliminer les sources d’informations environnementales, comme dans l’expérience de De Mairan avec le mouvement des feuilles d’une plante. Par exemple, on compare le patron de variation dans le temps du trait qui nous intéresse en présence d’un cycle lumineux jour-nuit avec le patron lorsqu’il n’y a pas d’information lumineuse. On pourrait par exemple utiliser une faible lumière constante si notre organisme est diurne. On fait ces mesures sur plusieurs jours afin de vérifier si le trait qui nous intéresse garde un rythme ou non. Le rythme peut être d’un peu moins ou d’un peu plus de 24 heures, mais il doit être présent pour parler de période en libre cours, comme on peut le voir pour l’activité locomotrice d’une souris (figure 12.5A). Il est possible que pour une espèce, on trouve qu’il n’y a pas de période en libre cours détectable pour un trait! On pourrait alors proposer qu’il n’y a pas de rythme endogène pour ce trait particulier. C’est le cas de l’activité locomotrice chez l’épinoche à trois épines, un poisson retrouvé en eau douce et en eau salée dans l’hémisphère nord (figure 12.5B).

3.3. L’entrainement d’un rythme par une variable environnementale
Si un individu a un trait dont le rythme suit un rythme environnemental, on dit que son rythme biologique est en phase avec le rythme environnemental. On peut aussi dire que le rythme de ce trait, par exemple l’activité, est entrainé au rythme environnemental. Il a peut-être une période en libre cours de 23,8 heures pour ce trait, mais lorsqu’exposé à un rythme environnemental, il est entrainé à une période de 24 heures.
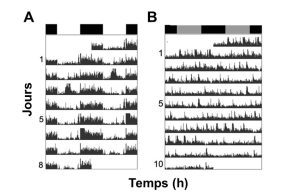
Cet effet d’entrainement est si important que, si on étudie un individu d’une espèce qui n’a pas de rythme circadien endogène pour l’activité, cet individu montrera des rythmes journaliers d’activité normaux s’il est exposé à une photopériode normale ou à un autre rythme environnemental journalier. Nous verrons plus bas que les rythmes endogènes sont liés à la présence d’une horloge biologique interne située dans une région spécifique du cerveau chez les mammifères. Si on étudie un individu qui porte une mutation qui rend son horloge interne inactive ou un individu qui a subi une ablation de la région du cerveau où est située l’horloge interne, l’environnement lumineux peut être suffisant pour maintenir un rythme journalier. Ces rythmes biologiques dépendent donc directement des cycles de lumière et disparaissent si on enlève le signal environnemental. On dit qu’ils sont sous contrôle exogène. C’est justement le cas de l’activité locomotrice des épinoches. Sous un cycle de lumière jour-nuit similaire au milieu naturel, les épinoches montrent une activité locomotrice nocturne (figure 12.6A) alors que ces rythmes disparaissent si on élimine le signal de la lumière (figure 12.6B).
3.4. Les zeitgebers
Un signal environnemental qui est capable « d’entrainer » (c’est-à-dire de « mettre en phase ») le rythme biologique s’appelle un zeitgeber. La traduction de ce mot allemand est « donneur de temps ». Chez les humains, les zeitgebers sont entre autres le cycle jour-nuit de lumière, la température, la prise alimentaire et l’influence sociale. Pour d’autres espèces, on peut aussi penser aux marées et aux variations d’humidité.
Exercices
Vérifiez votre compréhension des types de rythmes biologiques et de leur contrôle avec ce quiz formatif.
Rythme circadien
4. L’horloge biologique
Nous avons vu que certains rythmes sont maintenus même sans signal de zeitgeber et que pour ces rythmes on peut déterminer la période en libre cours. Nous avons aussi vu que d’autres rythmes sont entrainés par les signaux de l’environnement, mais disparaissent en absence de signal. Ils n’ont pas de période en libre cours détectable. Finalement, même les rythmes endogènes sont entrainés à une période de 24 heures par l’environnement externe, ce que l’on peut confirmer par le fait que leur période en libre cours est parfois différente de 24 heures et qu’elle est « réajustée » au monde extérieur chaque jour par un zeitgeber.
Comme on est en physiologie, on peut se demander quelles sont les causes proximales qui causent ces rythmes biologiques endogènes et comment ces rythmes sont liés aux zeitgebers du monde extérieur. En effet, si on connait comment l’organisme recueille les informations de l’environnement, quel est le mécanisme physiologique qui contrôle sa période en libre cours et comment ce rythme est transmis aux autres cellules du corps, cela nous aidera à tester l’idée que les rythmes circadiens sont une adaptation.
Les rythmes qui sont maintenus même en absence de zeitgeber sont contrôlés par une horloge biologique maitresse. Tous les vertébrés ont un ou des organes qui démontrent des rythmes circadiens intrinsèques, ce qui suggère la présence d’une horloge biologique maitresse. Ces horloges ont aussi été détectées entre autres chez diverses plantes, des insectes et des champignons. Cependant, les connaissances les plus avancées sont chez les mammifères et nous nous concentrerons donc sur ce groupe de vertébrés pour expliquer le fonctionnement de l’horloge biologique maitresse. Si vous êtes intéressés par l’horloge biologique de différents groupes de vertébrés, voir [7].
Nous allons voir où est cette horloge biologique maitresse dans le cerveau, comment elle est connectée aux zeitgebers du monde extérieur afin de permettre l’entrainement des rythmes et comment elle affecte l’horloge biologique des autres cellules du corps (figure 12.7). Eh oui, toutes les cellules du corps ont une horloge biologique. L’horloge biologique maitresse synchronise ces horloges dites « périphériques » directement et indirectement et elles sont aussi affectées directement par l’environnement. De plus, l’horloge biologique maitresse transfère l’information sur le signal lumineux à l’épiphyse, une glande endocrinienne qui sécrète une hormone selon un rythme jour-nuit, la mélatonine. Celle-ci affecte aussi les horloges biologiques périphériques (figure 12.7).
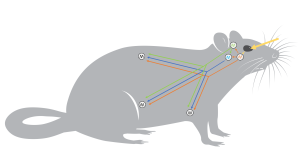
4.1. L’horloge biologique des mammifères et le noyau suprachiasmatique
On sait que l’horloge biologique maitresse des mammifères est située dans le noyau suprachiasmatique (NSC) de l’hypothalamus, que l’on peut voir représenté en rouge dans cette animation (figure 12.8).
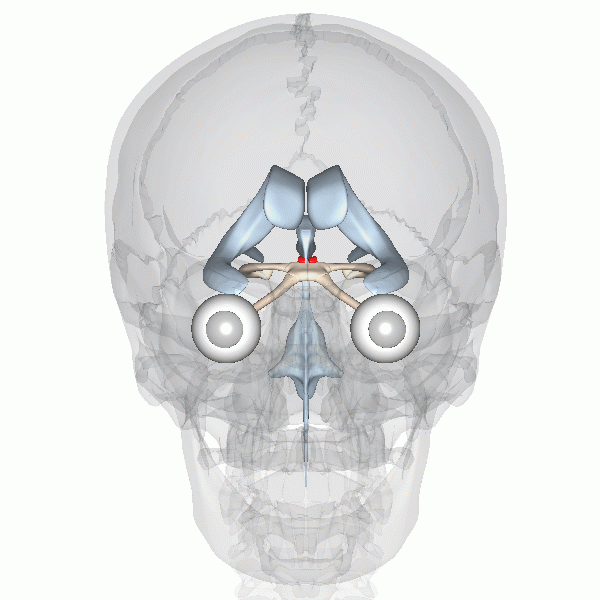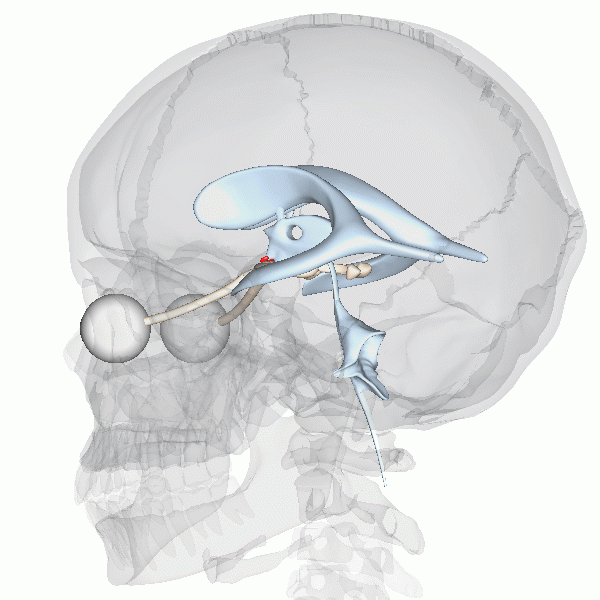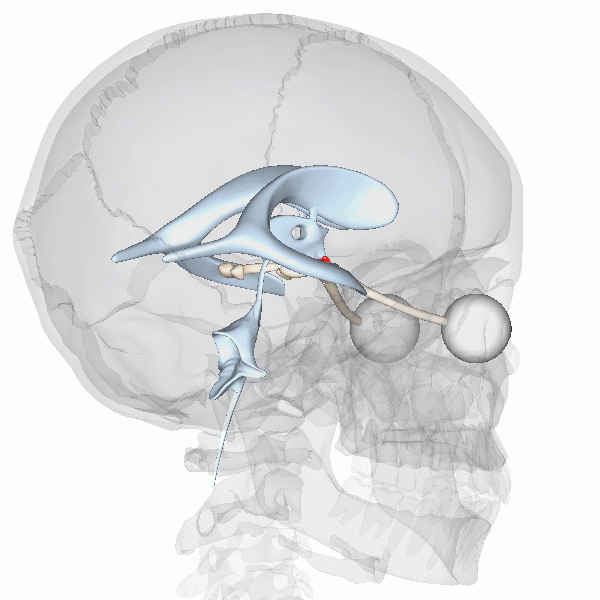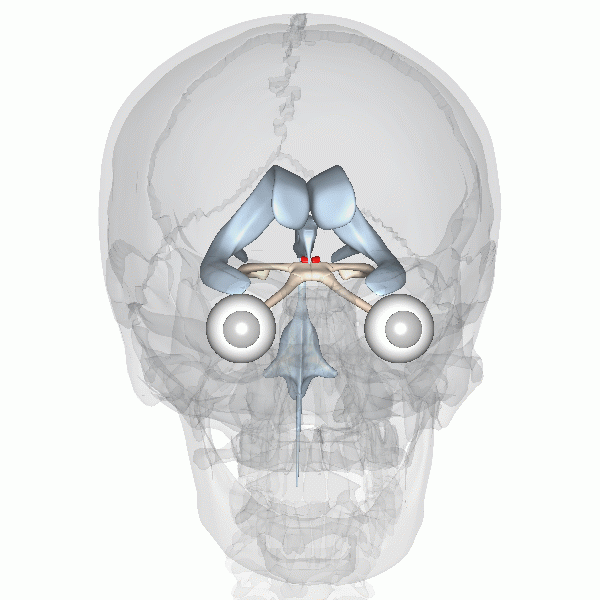
La fonction de cette région du cerveau a été déterminée par une expérience d’ablation et de remplacement, à l’aide d’une lésion. Les neurobiologistes ont d’abord démontré qu’un animal dont le NSC est détruit expérimentalement perd tout rythme circadien d’activité en photopériode constante. Cette expérience démontre que le NSC est nécessaire aux rythmes endogènes, mais ne nous permet pas de conclure que ces neurones sont suffisants pour créer les rythmes. Cela a été confirmé par une expérience de remplacement. Si on greffe un NSC fonctionnel d’un autre animal à un animal arythmique, on peut réinstaurer la rythmicité de son comportement. Un autre modèle qui a été utilisé pour vérifier le rôle du NSC de l’hypothalamus dans le contrôle endogène des rythmes circadiens est un hamster mutant qui a une période de 20 heures. Des neurobiologistes ont transplanté la région du cerveau qui contient les 10 000 neurones du NSC dans un hamster dont le NSC avait été détruit par lésion. Ce hamster qui n’avait pas de rythmes circadiens a recommencé à en avoir, mais avec la période du hamster mutant, soit 20 heures! Finalement, si on dissèque des neurones du NSC et qu’on les maintient en vie dans une culture en laboratoire, on observe que les potentiels d’action qu’ils génèrent ont un rythme endogène d’environ 24 heures. Ces expériences complémentaires supportent que le contrôle du rythme soit endogène et surtout que le NSC soit le site de l’horloge biologique maitresse endogène chez les mammifères.
L’horloge biologique du NSC est le maillon central qui relie l’environnement externe au fonctionnement des cellules de tous les tissus. Les cellules du NSC envoient leur signal aux autres cellules du corps et synchronisent directement ou indirectement de nombreuses fonctions physiologiques. Le NSC est aussi relié à l’épiphyse qui sécrète la mélatonine.
4.2 Fonctionnement de l’horloge biologique
Des biologistes ont utilisé la drosophile comme espèce modèle pour démontrer que le rythme de l’horloge biologique repose sur l’expression de gènes et l’action de leurs produits, les protéines. Plusieurs gènes impliqués dans la génération et la régulation des horloges biologiques ont été découverts chez différents organismes, que ce soit des vertébrés (mammifères, amphibiens, oiseaux, poissons), des insectes ou des plantes. Ces gènes fonctionnent de la même façon, mais ce ne sont pas toujours les mêmes protéines impliquées.
Comment est-ce que l’expression de différents gènes mène à un rythme? Dans la plupart des cas, comme par exemple chez les vertébrés et la drosophile, ce rythme est basé sur une boucle de rétrocontrôle de transcription et de traduction. Cette boucle est composée d’éléments positifs et négatifs. Les éléments positifs sont des facteurs de transcription qui activent l’expression de gènes de l’horloge moléculaire. Les éléments négatifs sont les produits des gènes de l’horloge (des protéines) qui inhibent leur propre expression. C’est un exemple de rétroaction négative. Ces produits protéiques qui agissent négativement sur leur propre transcription sont dégradés à un taux stable par le protéasome. Ces protéines disparaissent et les facteurs de transcription qui forment les éléments positifs ne sont donc plus inhibés. Cela entraine la transcription et la traduction des gènes de l’horloge moléculaire et la boucle continue. Ces boucles de rétroaction produisent des oscillations d’ARNm et de protéines de l’horloge. Les biologistes ont donné des noms évocateurs à ces différents gènes chez les mammifères. Un des gènes qui code pour un élément positif se nomme par exemple « CLOCK » alors qu’un des gènes qui code pour un élément négatif a pour nom « PERIOD ». On ne peut pas, dans un livre de physiologie, aller dans le détail des gènes impliqués dans l’horloge des différentes espèces, mais le concept général de boucle de rétrocontrôle de transcription et traduction est important à comprendre.
4.3. Étudier l’horloge biologique au niveau moléculaire
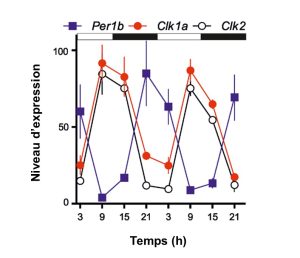
On a vu qu’on peut faire une étude de la fonction du noyau suprachiasmatique en utilisant une ablation d’une partie du cerveau. Pour étudier l’horloge biologique plus finement, on peut mesurer l’expression des gènes de l’horloge et leur produit. Par exemple, le niveau d’expression (c.-à-d. la quantité d’ARN messagers) d’un élément positif (« CLOCK ») et d’un élément négatif qui agit sur CLOCK (« PERIOD ») varie dans le cerveau d’un poisson-zèbre (figure 12.9). On voit très bien le rythme et la boucle de rétrocontrôle : la quantité d’ARN messagers de CLOCK augmente, ce qui induit l’expression de l’ARN messager de PERIOD qui augmente en quantité, ce qui a pour effet d’inhiber l’expression de CLOCK, qui redescend.
Dans cette vidéo, un des chercheurs qui a découvert la fonction du gène PERIOD explique comment cette découverte, qui a lui a mérité un prix Nobel, est arrivée. En résumé : grâce au basketball et un bon timing!
Entrevue avec Michael Rosbash.
iBiology Science Stories. (2015). Michael Rosbash (Brandeis): Understanding Circadian Rhythms [Vidéo]. Youtube. https://www.youtube.com/watch?v=kX8ruWyTXn4&ab_channel=iBiologyScienceStories
5. L’horloge biologique du NSC transmet son message au reste du corps par deux voies
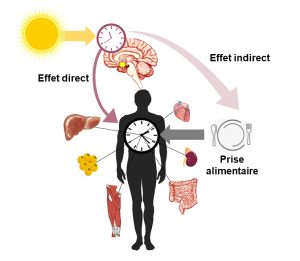
Maintenant que nous connaissons en gros le fonctionnement de l’horloge au niveau moléculaire et que nous savons qu’elle est située dans le cerveau, nous pouvons nous demander comment le signal de la lumière est intégré par l’organisme pour affecter sa physiologie. L’horloge biologique maitresse du NSC envoie son signal aux autres cellules du corps et synchronise directement ou indirectement de nombreuses fonctions physiologiques. Il y a deux grandes façons d’y arriver qui sont schématisées dans la figure 12.10.
Voie 1 : les gènes de l’horloge sont des facteurs de transcription qui affectent non seulement leur propre transcription, mais aussi celle de plusieurs autres gènes qui sont eux même des facteurs de transcription. L’horloge biologique maitresse affecte des rythmes biologiques majeurs tels que le cycle éveil-sommeil, ce qui a un effet sur les horloges périphériques.
Voie 2 : les neurones du noyau suprachiasmatique envoient un signal nerveux indiquant la présence de lumière à une glande endocrine, l’épiphyse, qui sécrète la mélatonine. Cette hormone agit sur de nombreux tissus.
5.1. Les effets des cellules du NSC sur les horloges périphériques
Les rythmes de l’horloge biologique des cellules du noyau suprachiasmatique ont des effets sur les horloges des tissus périphériques. Ces cellules en dehors du NSC ont aussi des rythmes autogénérés indépendamment, mais l’horloge maitresse a comme effet de les synchroniser. Par exemple, si on fait une lésion du NSC, les différents tissus, tel que le foie, les reins, le cœur, le pancréas, ont encore des rythmes, mais ils sont désynchronisés entre les tissus. Les horloges périphériques ont comme zeitgeber principal la prise alimentaire, qui contrôle de nombreux organes cruciaux pour le fonctionnement des systèmes physiologiques. Il a été proposé qu’en fait l’horloge maitresse du NSC agit sur ces tissus périphériques principalement en contrôlant les cycles d’éveil et de sommeil qui ont eux-mêmes un effet sur la prise alimentaire. De plus, plusieurs neurobiologistes pensent qu’il existe des molécules produites au niveau du NSC qui affectent les tissus périphériques qui n’ont pas encore été identifiées. Les effets de l’horloge maitresse sont donc directs et indirects.
5.2 Les effets des cellules du NSC sur l’épiphyse
Nous allons maintenant étudier l’hormone qui agit à l’interface entre l’environnement et l’organisme et qui est impliquée dans les rythmes biologiques. Nous prendrons l’exemple des mammifères. Cette hormone s’appelle la mélatonine. Voyons d’abord comment le zeitgeber de l’horloge maitresse, la lumière, est connecté à la sécrétion de cette hormone (figure 12.11).
La première étape se passe dans les yeux chez les mammifères. Les cellules de la rétine qui servent à envoyer un signal à l’horloge ne sont pas les mêmes que pour la vision. Les cellules impliquées sont dans une couche de cellules ganglionnaires (les « photosensitive retinal ganglion cells [pRGCs] ») de la rétine et portent dans leurs dendrites un photopigment spécifique, la mélanopsine. Ce sont donc des cellules de la rétine qui envoient un signal distinct de celui envoyé par les cônes et les bâtonnets. Le signal nerveux de ces cellules ganglionnaires est envoyé au NSC par les axones de ces cellules de la rétine, via le nerf optique (figure 12.11).
La deuxième étape se passe entre le NSC et l’épiphyse. Un signal nerveux part du NSC et projette à l’extérieur du système nerveux central jusqu’au ganglion cervical supérieur qui fait partie du système nerveux sympathique. Des neurones reviennent vers le système nerveux central par la moelle épinière jusqu’à l’épiphyse (figure 12.11).
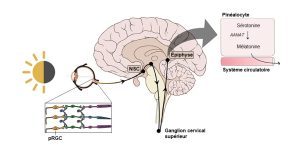
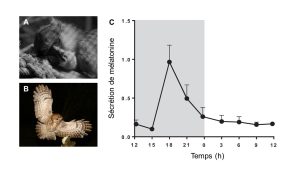
La troisième étape se passe dans l’épiphyse. Les neurones du système nerveux sympathique sécrètent de la noradrénaline la nuit (en absence de lumière), qui stimule les cellules de l’épiphyse, les pinéalocytes, à augmenter leur activité enzymatique qui convertit la sérotonine en mélatonine. En effet, l’augmentation du signal de la noradrénaline la nuit cause une protection de l’enzyme AANAT, ce qui mène à une augmentation de sa quantité et de son activité (de 10 à 100 fois plus active) qui convertit la sérotonine en mélatonine (figure 11). En contrepartie, durant le jour, l’enzyme AANAT est détruite en continu. Ainsi, une lumière vive (>2500 lux chez l’humain) supprime la production de mélatonine par l’épiphyse. Cela mène à la sécrétion de mélatonine la nuit et à une baisse de ses niveaux en circulation le jour.
5.3 Le rôle de la mélatonine
La mélatonine, qui est une hormone, est sécrétée dans le système circulatoire et agit sur ses récepteurs. Son action principale est de signaler l’absence de lumière, autrement dit, que c’est la nuit. Les espèces diurnes ET nocturnes sécrètent de la mélatonine la nuit (figure 12.12). Ce qui change entre ces deux types d’organismes, c’est ce que le cerveau fait avec cette information. Chez les animaux diurnes comme les humains, la mélatonine a un effet sur le sommeil. Il est important de noter que ce n’est pas vrai chez tous les primates! La mélatonine chez les humains diminue aussi l’activité motrice et électroencéphalique et affecte l’activité de l’hypothalamus, une région du cerveau impliquée dans la sécrétion d’hormones. Chez les animaux nocturnes, la sécrétion de mélatonine se passe aussi la nuit, mais est plutôt associée au début des activités de ces organismes.
6. Le photopériodisme
Un aspect intéressant de la sécrétion de la mélatonine durant la période de noirceur est que la durée de la synthèse et de sécrétion de la mélatonine va varier avec la photopériode. Le niveau de mélatonine devient donc une mesure hormonale de la durée du jour. De cette caractéristique découle le photopériodisme, soit l’utilisation de la longueur de la journée pour synchroniser un évènement annuel. Le système nerveux de plusieurs espèces utilise cette information hormonale pour synchroniser les systèmes physiologiques, comme la fonction reproductrice, avec des cycles environnementaux annuels (figure 12.13).
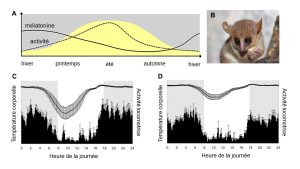
7. Est-ce que les rythmes biologiques sont une adaptation?
De nombreuses espèces ont un rythme pour un trait qui est maintenu sans signal environnemental et est donc sous contrôle endogène, c’est-à-dire que ce rythme a une période en libre cours mesurable. La question que l’on peut se demander c’est : «est-ce que ces rythmes biologiques endogènes sont des adaptations? ». L’hypothèse serait que les rythmes circadiens endogènes affectent le fitness des organismes qui vivent dans un milieu présentant des rythmes environnementaux jour-nuit. La prédiction qui découle de cette hypothèse est qu’un organisme aura un fitness plus élevé si la période de son horloge est plus proche des rythmes de l’environnement. On peut s’imaginer des biologistes qui étudient une plante modèle comme Arabidopsis thaliana, pour laquelle nous avons des informations sur le génome et qui peut être élevée en conditions contrôlées.
Exercices
Utilisez cette activité pour élaborer une expérience possible qui permettrait de tester cette prédiction qu’un organisme aura un fitness plus élevé si la période de son horloge est plus proche des rythmes de l’environnement.
Est-ce que les rythmes biologiques sont une adaptation?
Pour tester cette prédiction avec la plante Arabidopsis, les biologistes ont utilisé l’approche d’ingénierie phénotypique combinée à une transplantation [21]. Ils ont utilisé la manipulation génétique pour créer des mutations qui vont affecter la fonction d’un gène et mesurer le fitness des mutants dans leur environnement original et dans un autre environnement. Dans le cas présent, ils voulaient que la mutation affecte la période du rythme circadien. Ils ont créé une plante mutante avec une période plus longue que 24 heures (28 heures) et un mutant avec une période plus courte (20 heures). Ils ont mesuré la performance de croissance (qui est associée au fitness dans de nombreuses espèces de plantes) dans un environnement avec une période de 28 heures et dans un environnement avec une période de 20 heures. Si notre prédiction est vraie (un organisme aura un fitness plus élevé si la période de son horloge est plus proche des rythmes de l’environnement), la performance de chaque mutant sera maximum dans l’environnement qui a la même période que le rythme endogène de ce mutant. Ils ont aussi créé une plante mutante de type « on enlève le trait » : elle n’a plus de période en libre cours et est arythmique. Ils ont mesuré son fitness sur la terre, dans un environnement de laboratoire avec une période de 24 heures, en la comparant avec une plante sans mutation (qu’on appelle « de type sauvage »). Selon notre hypothèse, si avoir un rythme circadien est une adaptation à la vie sur terre, on prédira que la performance de croissance de cette plante mutante sans rythme endogène sera plus faible.
8. La capacité d’anticipation liée à l’horloge biologique
La grande différence entre une plante mutante sans rythme biologique endogène et celle avec un rythme endogène est que l’organisme qui a une horloge biologique avec une période similaire à son environnement peut « prédire » ce qui s’en vient dans son environnement. Il a une capacité d’anticipation. Cet organisme n’a pas à seulement réagir une fois que le changement est fait, comme le fait un animal dont le NSC est détruit ou qui a une mutation dans un des gènes de l’horloge biologique. Cette capacité d’anticipation lui permet de moins dépenser d’énergie pour rien, de la dépenser au bon moment, de faire les bons choix et de se situer dans le temps en plus de dans l’espace. Sa performance physiologique et ultimement son fitness sont affectés par cette capacité d’anticipation.
Par exemple, juste avant de se réveiller, nous avons un pic de sécrétion de cortisol. Cette hormone a des effets sur plusieurs aspects de notre physiologie car ses récepteurs sont distribués sur de nombreux tissus et, par conséquent, elle affecte une grande variété de traits. Par exemple, des études chez les rongeurs ont démontré que ce pic de cortisol affecte des régions du cerveau liées à la vigilance, à la sensation de faim, à la prise alimentaire, aux émotions, à l’anxiété, au système de récompense, au sommeil, à la cognition et à la mémoire. Ces récepteurs sont aussi présents dans le foie, les muscles, les tissus adipeux, le cœur, les reins, les poumons, la peau, les os et les gonades. Cette hormone a ainsi des effets sur le métabolisme des lipides, la gluconéogenèse, l’atrophie musculaire, l’absorption intestinale, l’inflammation, la filtration rénale, le développement des gamètes, la résorption osseuse, etc. Ce pic de sécrétion de cortisol a lieu le matin pour les espèces diurnes et le soir pour les espèces nocturnes. Si un organisme n’a pas d’horloge biologique, il n’a pas ce pic de sécrétion de l’hormone cortisol avant le réveil et toutes les fonctions énumérées si haut sont potentiellement affectées, ce qui diminue différentes mesures de performance [22].
Le laboratoire de Patricia DeCoursey a testé l’effet de l’absence d’une horloge fonctionnelle sur le fitness de mammifères, particulièrement sur les tamias et les écureuils. Les membres de son laboratoire ont utilisé des enclos semi-naturels où ils ont placé des individus intacts ou avec une lésion du NSC. Ils ont ensuite mesuré le taux de prédation. Ils ont démontré que les individus avec une lésion du NSC, qui n’avaient pas d’horloge biologique fonctionnelle, étaient morts plus souvent à cause des prédateurs. Des effets sur le fitness ont été aussi mesurés chez des insectes et dans des études subséquentes chez d’autres mammifères placés en milieu semi-naturel, suggérant que cette capacité d’anticipation est cruciale pour la performance des individus et affecte leur fitness.
Cas appliqué
Entrevue avec Marie-Pier Brochu
Cette capsule vidéo présente une entrevue avec Marie-Pier Brochu, étudiante au doctorat en Sciences de l’eau dans le laboratoire de Valérie Langlois à l’INRS à Québec. Ses travaux portent sur l’étude des rythmes biologiques à la maîtrise et de l’utilisation de l’ADN environnemental au doctorat. Vous pouvez activer les sous-titres en français.
Aubin-Horth, N. (2024). Écophysiologie évolutive: Marie-Pier Brochu. [Vidéo]. Youtube. CC-BY. https://youtu.be/1PkO7IfFgkY?si=IWHQ-oYsqKZOICTZ
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien. Transcription Brochu en format Word
Des poissons chanteurs
Dans cette capsule intitulée « les poissons chanteurs dépendent des rythmes circadiens et de la mélatonine pour le moment de la vocalisation nocturne de la parade nuptiale », des biologistes nous présentent leur étude des comportements de reproduction chez un poisson qui montre un rythme endogène circadien et qui est directement affecté par les niveaux de mélatonine.
Cell Press. (2016). Singing Fish, Circadian Rhythms, and Melatonin/ Curr. Biol., Sep. 22, 2016 (Vol. 26, Issue 19) [Vidéo]. Youtube. https://www.youtube.com/watch?v=EHHhiawIdWM&ab_channel=CellPress
Résumé
Différents traits ont des rythmes biologiques chez les organismes vivant sur terre et des rythmes avec des périodes variées existent. On peut caractériser ces rythmes par une représentation visuelle et quantifier leurs caractéristiques, tel que la période. Un rythme peut être sous contrôle endogène avec une période en libre cours distincte. Des variables de l’environnement peuvent avoir un contrôle exogène sur un rythme. Ces variables sont appelées des zeitgebers. Il est aussi possible de déterminer si la présence d’un rythme endogène a un effet sur le fitness, autrement dit, si c’est une adaptation.
Activité de révision
Exercices
Révision sur les rythmes biologiques
Bibliographie
- Peppergrower (2009). A plot showing simple harmonic motion (e.g., sine and/or cosine functions), along with its amplitude and period [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Simple_harmonic_motion.svg
- Geissmann, Q., P.K. Abram, D. Wu, C.H. Haney et J. Carrillo (2022). Sticky Pi is a high-frequency smart trap that enables the study of insect circadian activity under natural conditions [CC-BY]. PLOS Biology, 20(7). https://doi.org/10.1371/journal.pbio.3001689
- Hundahl, C.A., J. Fahrenkrug, A. Hay-Schmidt, B. Georg, B. Faltoft et J. Hannibal (2012). Circadian behaviour in neuroglobin deficient mice [CC-BY-SA]. PLoS One, 7(4). https://doi.org/10.1371/journal.pone.0034462
- Donatelli, A., G. Mastrantonio et P. Ciucci (2022). Circadian activity of small brown bear populations living in human-dominated landscapes [CC-BY]. Scientific Reports, 12(1). https://doi.org/10.1038/s41598-022-20163-1
- Suyash.dwivedi (2019). Mimosa pudica in September month [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Mimosa_pudica_in_September_month.jpg
- Brochu, M.-P. et N. Aubin-Horth (2021). Shedding light on the circadian clock of the threespine stickleback [CC-BY]. Journal of Experimental Biology, 224(24). https://doi.org/10.1242/jeb.242970
- Patton, A.P. et M.H. Hastings (2018). The suprachiasmatic nucleus. Current Biology, 28(15), R816-R822. https://doi.org/10.1016/j.cub.2018.06.052
- Auteur inconnu (2020). Rat profile [domaine public]. https://freesvg.org/rat-1578355258
- BodyParts3D/Anatomography par DBCLS (2018). Suprachiasmatic nucleus (red) and ventricular system (blue) [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Suprachiasmatic_nucleus_and_ventricular_system.gif
- Cavallari, N., E. Frigato, D. Vallone, N. Fröhlich, J.F. Lopez-Olmeda, A. Foà, R. Berti, F.J. Sánchez-Vázquez, C. Bertolucci et N.S. Foulkes (2011). A blind circadian clock in cavefish reveals that opsins mediate peripheral clock photoreception [CC-BY]. PLoS Biology, 9(9). https://doi.org/10.1371/journal.pbio.1001142
- Pickel, L. et H.K. Sung (2020). Feeding rhythms and the circadian regulation of metabolism [CC-BY]. Frontiers in Nutrition, 7, 20. https://doi.org/10.3389/fnut.2020.00039
- Tonon, A.C., L.K. Pilz, R.P. Markus, M.P. Hidalgo et E. Elisabetsky (2021). Melatonin and depression: A translational perspective from animal models to clinical studies [CC-BY]. Frontiers in Psychiatry, 12, 13. https://doi.org/10.3389/fpsyt.2021.638981
- Henley, C. Light in the Retina [CC-BY-NC-SA]. https://openbooks.lib.msu.edu/neuroscience/chapter/vision-the-retina/
- Fischer, H. (2015). Artwork [CC-BY]. https://commons.wikimedia.org/wiki/File:Editable_ray_diagram_of_eye_v0.svg
- Córdoba-Moreno, M.O., E.D.S. De Souza, C.L. Quiles, D. Dos Santos-Silva, G.S. Kinker, S.M. Muxel, R.P. Markus et P.A. Fernandes (2020). Rhythmic expression of the melatonergic biosynthetic pathway and its differential modulation in vitro by LPS and IL10 in bone marrow and spleen [CC-BY]. Scientific Reports, 10(1). https://doi.org/10.1038/s41598-020-61652-5
- Jake (2012). Sleeping Monkey [CC-BY-NC-SA]. https://www.flickr.com/photos/insidiatorphotos/6636829253/
- Abel, M. (2019). Night Flight (4A7A-2777) [CC-BY-NC-SA]. https://www.flickr.com/photos/markabel/50986152122/
- van Dalum, J., V.J. Melum, S.H. Wood et D.G. Hazlerigg (2020, Jan). Maternal photoperiodic programming: melatonin and seasonal synchronization before birth [CC-BY]. Frontiers in Endocrinology, 10, 7, Article 901. https://doi.org/10.3389/fendo.2019.00901
- Haverkamp, A. (2007). Gray mouse lemur at Artis Zoo, Amsterdam, Netherlands [CC-BY]. https://commons.wikimedia.org/wiki/File:Microcebus_murinus_-Artis_Zoo,_Amsterdam,_Netherlands-8c.jpg
- Le Tallec, T., M. Perret et M. Théry (2013). Light pollution modifies the expression of daily rhythms and behavior patterns in a nocturnal primate [CC-BY]. PLoS One, 8(11). https://doi.org/10.1371/journal.pone.0079250
- Dodd, A.N., N. Salathia, A. Hall, E. Kevei, R. Toth, F. Nagy, J.M. Hibberd, A.J. Millar et A.A.R. Webb (2005). Plant circadian clocks increase photosynthesis, growth, survival, and competitive advantage. Science, 309(5734), 630-633. https://doi.org/10.1126/science.1115581
- Oster, H., E. Challet, V. Ott, E. Arvat, E.R. de Kloet, D.J. Dijk, S. Lightman, A. Vgontzas et E. Van Cauter (2017). The functional and clinical significance of the 24-hour rhythm of circulating glucocorticoids. Endocrine Reviews, 38(1), 3-45. https://doi.org/10.1210/er.2015-1080

