20. Évolution de la réponse à l’hypoxie
Introduction
Dans ce chapitre, nous aborderons l’évolution de la réponse physiologique à l’hypoxie chez les populations qui vivent dans des environnements pauvres en oxygène. Nous verrons comment on mesure la tolérance à l’hypoxie d’un organisme chez différents groupes d’animaux. Nous étudierons ensuite spécifiquement ce qui a changé dans la physiologie de certaines populations d’humains qui vivent en altitude et qui résistent mieux à l’hypoxie, comparativement aux personnes des basses terres. Nous verrons des adaptations physiologiques des Tibétains et les bases génétiques qui les sous-tendent. Finalement, nous discuterons de l’origine de ces différences génétiques et de l’apport des génomes d’autres groupes d’humains par introgression menant à ces adaptations à l’altitude.
Objectifs spécifiques
À la fin de ce chapitre, vous serez en mesure de :
- Expliquer les mesures de tolérance à l’hypoxie utilisées chez différents groupes d’animaux
- Contraster les réponses physiologiques observées en réponse à l’hypoxie chez des populations provenant des basses terres ou de sites en altitude.
- Déterminer s’il y a de l’évolution convergente dans la réponse à l’hypoxie en altitude entre différentes populations humaines
- Appliquer une approche de génomique afin de trouver des traits physiologiques candidats pour expliquer l’adaptation à l’hypoxie
- Interpréter les résultats d’une analyse expérimentale de la fonction d’un gène potentiellement sous sélection
- Expliquer la variation génétique existante et l’introgression comme source de variation génétique
Notions clés
- Mesurer la tolérance à l’hypoxie
- Chez les organismes aquatiques
- La survie
- La tension critique en oxygène
- La perte d’équilibre
- La respiration de surface
- Chez les animaux terrestres
- La survie
- La réponse ventilatoire
- Divergence entre les populations humaines dans la réponse physiologique à l’hypoxie
- La réponse du système respiratoire diffère entre les humains des basses terres et les Tibétains
- La réponse du système circulatoire diffère entre les humains des basses terres et ceux adaptés à l’altitude
- L’étude des adaptations physiologiques à l’altitude grâce à la génomique
- Analyse expérimentale de la fonction du gène EPAS
- Variation génétique existante versus nouvelle mutation
1. Mesurer la tolérance à l’hypoxie
Certains animaux sont plus tolérants que d’autres à l’hypoxie. Les physiologistes utilisent différentes mesures pour quantifier la tolérance à l’hypoxie chez les animaux. Chez les espèces aquatiques, on utilisera le taux de survie face à un certain niveau d’hypoxie pour une période donnée, la tension critique en oxygène, le niveau d’hypoxie auquel un individu perd l’équilibre, ou encore l’apparition de comportements comme la respiration en surface chez les poissons. Chez les animaux terrestres, on définit la tolérance par la capacité de survie face à une faible pression partielle d’O2 pour une certaine durée de temps. Les physiologistes vont aussi caractériser l’intensité des réponses physiologiques aux niveaux non létaux d’hypoxie chez les individus et les classer comme tolérants ou intolérants selon leurs caractéristiques. Pour les environnements aquatiques et terrestres et pour ces différentes mesures, on retrouvera des différences interindividuelles qui ont plusieurs causes non exclusives et peuvent être attribuées à la variation génétique et à la variation environnementale. En effet, les individus peuvent s’acclimater à l’hypoxie, ce qui modifiera leur réponse et leur caractérisation comme tolérant ou intolérant. De plus, chez différentes espèces d’animaux, les niveaux d’oxygène auxquels un individu fait face en début de vie peuvent affecter la tolérance à l’hypoxie à l’âge adulte, dû à la plasticité phénotypique.
1.1 Chez les organismes aquatiques
Chez les organismes aquatiques, la tolérance à l’hypoxie est mesurée à une température donnée, car la plupart des organismes aquatiques qui utilisent l’O2 dissoute dans l’eau sont ectothermes. La température affecte leur métabolisme et donc leurs besoins en O2, mais aussi la quantité d’oxygène dissoute dans l’eau qui est disponible. La salinité affecte aussi la tolérance chez de nombreuses espèces, tout comme le pH de l’eau et la pollution. De plus, le stade de vie, la présence et durée d’une période d’acclimatation ou le développement à un certain niveau d’O2 sont aussi des facteurs qui affectent la tolérance à l’hypoxie. Finalement, toutes les demandes métaboliques supplémentaires comme le mouvement, la digestion, la croissance, le développement de gonades et la reproduction doivent être aussi prises en compte [1, 2].
1.1.1 La survie
Les physiologistes peuvent utiliser la survie afin de quantifier la tolérance à l’hypoxie. Ils utilisent la durée de la survie face à un certain niveau d’O2. Le taux de changement d’O2 choisi pour l’expérience peut affecter la durée de survie, et la réponse face à différents taux de baisse d’oxygène peut être ce qui intéresse les physiologistes. Comme noté plus haut, de nombreuses variables affectent la survie à un niveau d’hypoxie donné et celles-ci doivent être prises en compte [3].
1.1.2 La tension critique en oxygène
La section 1.1.2 est adaptée de [2].
Les poissons peuvent déclencher de nombreuses réponses physiologiques qui visent principalement à soutenir l’extraction de l’oxygène de l’environnement afin de maintenir la production d’ATP de manière aérobique (ex : augmenter leur taux de ventilation). Ces réponses permettent à la majorité des poissons de maintenir des taux d’absorption d’oxygène stables sur une large gamme de pressions partielles ambiantes d’oxygène (pO2), une réponse connue sous le nom d’« oxyrégulation ». Cependant, lorsque l’oxygène diminue jusqu’à un seuil en dessous duquel le taux d’absorption d’oxygène ne peut pas être maintenu, l’absorption d’oxygène diminue linéairement avec une diminution de la pO2 ambiante, une réponse dite « oxyconformante ». Ce seuil, lorsque la consommation d’oxygène passe de la régulation à la conformité, est appelé la tension critique en oxygène, ou pO2 critique (Pcrit). En tant que mesure de la capacité d’extraction d’oxygène de l’animal entier, qui varie considérablement selon les espèces et les populations, Pcrit est largement utilisé pour décrire le degré de tolérance à l’hypoxie chez les poissons.
Cet indicateur obtenu en laboratoire est affecté par les changements physiologiques qui affectent la cascade de transport de l’oxygène (par exemple, la structure des branchies) et est donc pertinent pour prédire ce qui se passe en milieu naturel [4]. Comme tous les autres indicateurs de tolérance à l’hypoxie, il est affecté par l’environnement de l’organisme au moment où il est étudié (température, salinité), par l’acclimatation et par la plasticité du développement [4-6].
1.1.3 La perte d’équilibre
La section 1.1.3 est adaptée de [7].
Un des indices de tolérance à l’hypoxie le plus fréquemment mesurés chez les poissons est le niveau d’oxygène auquel un individu est incapable de maintenir sa position dans la colonne d’eau, ou le temps requis pour atteindre cette perte d’équilibre à un niveau d’hypoxie donné (perte d’équilibre, appelée LOE en anglais pour loss of equilibrium). Lors de réductions extrêmes d’oxygène, les poissons deviennent incapables de coordonner leurs mouvements et de s’orienter. Ils démontrent alors une perte d’équilibre. La mort survient peu de temps après, à moins que les poissons ne soient transférés dans une eau bien oxygénée, où ils se rétablissent complètement. Le temps jusqu’à la perte d’équilibre et le niveau d’oxygène auquel on peut mesurer une perte d’équilibre ont donc été utilisés comme mesures non létales de tolérance à l’hypoxie, qui peuvent prédire la survie lors d’une variation naturelle de l’oxygène (figure 20.1). La perte d’équilibre se produit à des niveaux d’oxygène beaucoup plus faibles que les autres mesures de tolérance et peut être liée à l’épuisement des substrats ou à l’accumulation de produits finaux du métabolisme anaérobie.
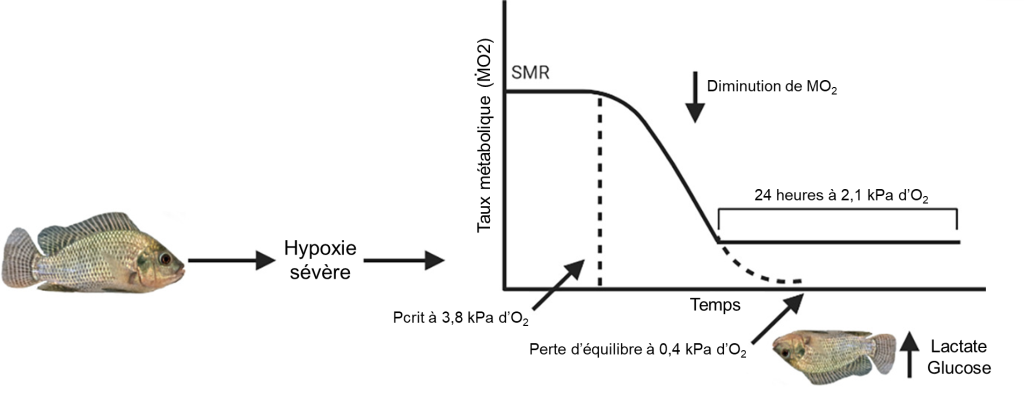
1.1.4 La respiration de surface
La section 1.1.4 est adaptée de [7].
Un autre indice de tolérance à l’hypoxie fréquemment mesuré chez les poissons est la propension de certaines espèces à utiliser une respiration de surface aquatique (nommé ASR en anglais pour Aquatic Surface Respiration). Lors de ce comportement, les poissons s’approchent de la surface et irriguent leurs branchies avec la couche d’eau la plus près de la surface, riche en oxygène en raison de la diffusion depuis l’air. Lorsqu’ils sont soumis expérimentalement à une hypoxie, les poissons qui utilisent la respiration de surface présentent des taux de survie et de croissance plus élevés que les poissons qui n’ont pas accès à la surface. De plus, ce comportement offre l’avantage écologique de pouvoir exploiter des habitats chroniquement hypoxiques. Les poissons n’effectuent pas de respiration de surface à des réductions modérées d’oxygène, ce qui suggère que ce comportement a des couts, probablement un cout énergétique pour maintenir sa position près de la surface, ainsi qu’un risque accru de prédation par des prédateurs aériens. Ainsi, la fréquence de la respiration de surface est essentiellement nulle lorsque les niveaux d’oxygène sont normaux et augmente considérablement lorsque l’oxygène tombe en dessous d’un seuil caractéristique [9]. La respiration de surface est un comportement complexe qui intègre la disponibilité en oxygène, la demande en oxygène, la menace perçue de prédation et probablement d’autres variables permettant de déterminer le moment où un poisson fait surface.
1.2 Chez les animaux terrestres
Chez les animaux terrestres, la tolérance à l’hypoxie varie grandement, si on étudie les grands groupes d’invertébrés et de vertébrés qui utilisent l’oxygène atmosphérique. À l’intérieur des vertébrés, on trouve des espèces très tolérantes à l’hypoxie et même à l’anoxie, par exemple chez les reptiles comme la tortue peinte, Chrysemys picta (figure 20.2A). Cette espèce de tortue peut survivre 4 mois en anoxie lorsqu’elle est en dormance hivernale. Chez les mammifères, on remarque que les stades juvéniles sont plus tolérants à l’hypoxie que les adultes pour une espèce donnée [10]. On remarque aussi des différences notables de tolérance à l’hypoxie chez les mammifères marins (qui bien sûr ne sont pas des animaux terrestres, mais qui respirent de l’air comme leurs ancêtres terrestres) qui plongent en apnée pour de longues périodes, comme le cachalot, Physeter catodon (figure 20.2B) comparativement aux mammifères qui ne plongent pas, comme les humains [11].

1.2.1 La survie
Comme chez les animaux aquatiques, on peut quantifier le temps pendant lequel un individu peut survivre face à un certain niveau d’hypoxie ou le niveau d’hypoxie auquel 50 % des individus testés meurent. Selon que l’espèce est homéotherme ou non, il faudra prendre la température en compte lors de la mesure [14]. On peut ainsi comparer des individus de la même espèce provenant de différentes populations. Par exemple, les poulets domestiques tibétains, qui sont élevés en altitude depuis 1000 ans, semblent avoir une meilleure aptitude à la vie en altitude (autrement dit, face à l’hypoxie) que les poulets des basses terres. Des biologistes ont comparé l’impact de l’environnement (normoxie; 21 % d’O2 versus hypoxie; 13 % d’O2) sur la mortalité des poulets de la fertilisation jusqu’à l’éclosion entre les deux populations (Tibétains versus poulets des basses terres). Une différence significative de mortalité survient en hypoxie alors que les poulets tibétains ont une survie significativement plus élevée que les poulets des basses terres [15, 16].
1.2.2 La réponse ventilatoire
Les physiologistes peuvent déterminer la tolérance à un certain niveau d’hypoxie en étudiant la réponse ventilatoire aigüe de l’organisme. Un individu intolérant aura une réponse d’hyperventilation face à une baisse de la pression partielle d’O2. C’est la réponse typique d’augmentation de la fréquence de ventilation face à l’hypoxie que nous avons vue lorsque nous avons discuté du contrôle de la respiration afin de maintenir l’équilibre gazeux et de pH sanguin. Cette réponse sera absente au même niveau d’hypoxie chez une espèce tolérante, qui aura plutôt une réponse de diminution de l’utilisation de l’oxygène ( V̇O 2) [11]. Par exemple, des biologistes étudiant un mammifère fouisseur de la famille des taupes, le condylure étoilé, ont quantifié une réponse d’hyperventilation et ont conclu que cette espèce n’est pas tolérante à l’hypoxie, contrairement à de nombreuses autres espèces utilisant ce type d’habitat souterrain [14].
2. Divergence entre les populations humaines dans la réponse physiologique à l’hypoxie
La section 2 est adaptée de [17].
En milieu terrestre, l’hypoxie est rencontrée principalement en altitude. Au niveau de la mer, la pression atmosphérique est d’environ 100 kPa. À cette pression atmosphérique, l’air est dense et l’oxygène passe facilement de l’air des poumons à travers les membranes cellulaires jusqu’à la circulation sanguine. En effet, la pression partielle d’oxygène dans l’air que nous respirons affecte la diffusion dans notre sang. Ainsi, à mesure que la pression atmosphérique diminue à haute altitude, la pression partielle d’O2 diminue. Il devient plus difficile pour une quantité adéquate d’oxygène de passer dans la circulation sanguine et les niveaux d’oxygène dans le sang commencent à baisser.
À 2 500 mètres d’altitude, la pression atmosphérique ne représente qu’environ 75 pour cent de celle du niveau de la mer, et à 5000 mètres, la pression atmosphérique ne représente qu’environ 50 pour cent de la valeur du niveau de la mer. Cette dernière altitude correspond à peu près à l’altitude du camp de base du mont Everest et de l’établissement humain permanent le plus élevé (La Rinconada au Pérou, illustrée sur la figure 20.3). Les altitudes supérieures à 2 500 mètres nécessitent généralement une acclimatation ou une adaptation pour prévenir les symptômes dus à l’hypoxie. Au-dessus de 7 500 mètres, de graves symptômes d’hypoxie sont susceptibles de se développer. Les altitudes supérieures à 8000 mètres se situent dans la « zone de la mort ». C’est la zone où l’hypoxie devient trop importante pour soutenir la vie humaine. Le sommet de l’Everest, culminant à 8 848 mètres d’altitude, se situe définitivement dans la zone de la mort. Les alpinistes venant des basses terres ne peuvent y survivre en général qu’en consommant davantage d’oxygène dans les réservoirs d’oxygène et en ne restant pas très longtemps au sommet.

Malgré ces contraintes à la vie exceptionnelles, les humains ont colonisé à plusieurs reprises des environnements en haute altitude (figure 20.4). On estime que plus de 100 millions de personnes dans le monde vivent à des altitudes supérieures à 2 500 mètres au-dessus du niveau de la mer. Les humains vivent sur les plateaux des Andes (l’Altiplano) depuis 11 000 ans et les humains sont présents dans la région du Tibet (plateau tibétain) depuis presque 30 000 ans.
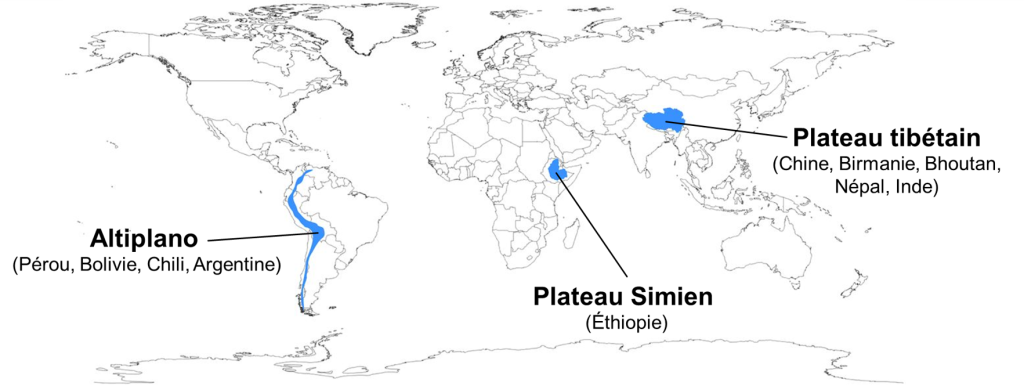
Comparativement aux humains de basse altitude qui font péniblement face à l’hypoxie en altitude, les populations de ces régions semblent faire face à ce défi différemment. Une des questions que l’on peut se poser concerne la possibilité d’évolution convergente. En effet, on retrouve des populations en haute altitude à plusieurs endroits du monde et ces populations sont isolées les unes des autres depuis des milliers d’années. Si ces populations présentent des traits qui améliorent leur performance physiologique en altitude, est-ce que les pressions de sélection liées à l’altitude ont entrainé l’évolution d’un seul et même mécanisme physiologique adaptatif? Ou bien des voies différentes ont-elles été suivies par l’évolution?
2.1 La réponse du système respiratoire diffère entre les humains des basses terres et ceux adaptés à l’altitude
Nous avons vu que la réponse du système respiratoire à l’hypoxie aigüe entraine une augmentation du taux de ventilation chez les humains. Pour illustrer cette réponse qui se produit en altitude, nous pouvons utiliser un sujet humain qui a grandi et qui vit à une basse altitude et la placer à une altitude assez élevée pour affecter l’apport en oxygène. Examinons la réponse d’une touriste qui monte en train en quelques heures à environ 3450 m sur le glacier Jungfraujoch en Suisse, face à une saturation d’oxygène autour de 65 % de celle rencontrée au niveau de la mer. Nous mesurerons la fréquence de ventilation du sujet.
Réponse physiologique d’une personne provenant des basses terres qui fait face à une baisse d’oxygène à une altitude de 3450 mètres.
Aubin-Horth, N. (2023). Sur le glacier du Jungfrau à 3450 mètres d’altitude [Vidéo]. Youtube. https://youtu.be/kjLnXH0K6cY
Comme vous pouvez le voir, dans cette expérience, on observe une augmentation de la fréquence de ventilation lorsque le sujet est placé en hypoxie. Dans la vidéo, on la voit prendre 6 respirations en 15 secondes, alors qu’un adulte au niveau de la mer en prendrait environ 3 ou 4. Elle mentionne aussi que ses battements cardiaques sont à 120 battements par minute, alors que le cœur d’une personne du même âge au repos à basse altitude battrait entre 50 et 85 fois à la minute. Son corps a reçu un signal de baisse de pression partielle d’oxygène (pO2) sanguin par les chémorécepteurs périphériques qui mesurent cette baisse et envoient un signal au centre d’intégration dans le système nerveux central. Les circuits respiratoires activent des neurones moteurs qui activent à leur tour des effecteurs, les muscles intercostaux et du diaphragme. Cela entraine une augmentation de la fréquence de la ventilation. On classerait cette personne comme intolérante à l’hypoxie en se basant sur cette réponse d’hyperventilation. Nous savons que cette réponse d’hyperventilation aura des conséquences néfastes sur son pH sanguin en éliminant une trop grande quantité de CO2 lors de l’expiration. Cette réponse d’hyperventilation disparait avec l’acclimatation.
Chez les populations vivant en altitude (figure 20.4), on observe des réponses ventilatoires divergentes. Les Andéens n’augmentent pas leur taux de ventilation face à l’hypoxie. Cette absence de réponse est possiblement une adaptation à l’altitude. À l’opposé, les Tibétains ont un taux de ventilation similaire à un individu des basses terres acclimaté à l’altitude. Cela suggère en revanche qu’ils ont peut-être des différences physiologiques permettant de contrer les effets de l’hyperventilation sur le pH sanguin [19].
2.2 La réponse du système circulatoire diffère entre les humains des basses terres et ceux adaptés à l’altitude
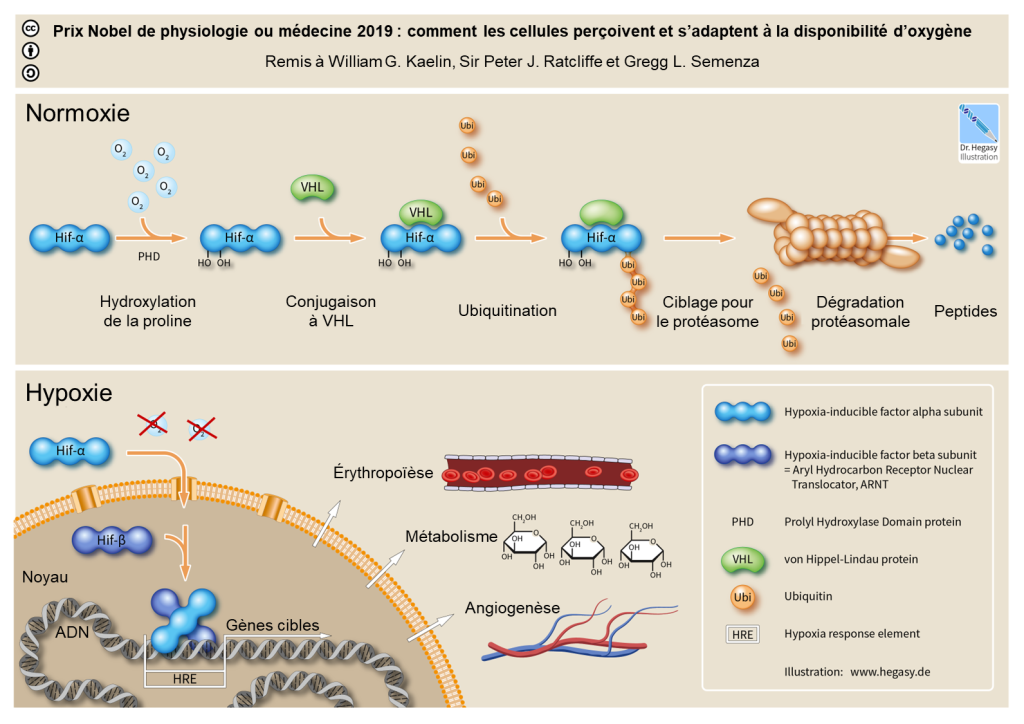
Nous avons vu que la réponse à court terme du système circulatoire face à l’hypoxie entraine entre autres une augmentation du rythme cardiaque (d’ailleurs mesuré chez notre sujet humain dans l’expérience sur le glacier Suisse ci-haut). La réponse à l’hypoxie du système circulatoire inclut aussi une augmentation du nombre de globules rouges et de la quantité d’hémoglobine à la suite de l’activation de la cascade du facteur de transcription HIF-1 (figure 20.5). On pourrait donc formuler l’hypothèse qu’il y a des changements dans le système circulatoire des humains vivant en altitude au Tibet et dans les Andes. Plus spécifiquement, on pourrait prédire que la quantité d’hémoglobine dans le sang sera plus élevée chez les Tibétains et les Andéens que chez les individus des basses terres qui ne font pas face à l’hypoxie.
Des physiologistes ont étudié la concentration d’hémoglobine chez les Andéens et les Tibétains. Ils ont démontré une différence significative de la quantité d’hémoglobine entre les Andéens et des individus de basse altitude [20]. Les Andéens ont une haute quantité d’hémoglobine, comme chez des humains qui répondent à l’hypoxie à court terme. Cependant, les Andéens et les Tibétains sont très différents dans leur concentration d’hémoglobine. En effet, le niveau des Tibétains est plus bas que le niveau des Andéens [21]. Une autre équipe de physiologistes a quantifié le niveau d’hémoglobine directement sur le terrain à différentes altitudes, pour des Tibétains et des Chinois Han (les Chinois Han sont des migrants récents, ils ne sont pas nécessairement nés au Tibet et ils y sont arrivés plus ou moins tard dans leur vie). Ils ont mesuré que la concentration d’hémoglobine augmente pour les deux groupes avec l’altitude, mais pour une altitude donnée, l’hémoglobine est plus élevée chez les Chinois Han que chez les Tibétains [22]. Peut-être qu’ici on a affaire à une adaptation chez les Tibétains où le trait adaptatif serait d’avoir une réponse moins prononcée d’augmentation de la production de globules rouges en réponse à l’hypoxie. On peut supposer que cela représente un compromis entre augmenter l’apport en oxygène aux tissus et limiter l’augmentation de la viscosité du sang. Cependant, dans ce cas-ci on ne sait pas si les Tibétains ont cette réponse parce qu’ils sont nés et ont grandi en altitude (réponse de plasticité développementale) ou si ce sont des différences génétiques qui sous-tendent ces différences de phénotypes. On ne sait pas non plus si ces différences de niveaux d’hémoglobines affectent la performance et ultimement le fitness.
Il semble que deux chemins évolutifs différents sont possibles face à la pression de sélection de l’hypoxie. Les adaptations locales des Andéens et des Tibétains reposent sur des mécanismes physiologiques différents. On observe une convergence évolutive de la physiologie, c’est-à-dire un maintien de la quantité d’O2 pour le fonctionnement des cellules, sans convergence des mécanismes. Il y a donc plus qu’une façon de répondre au défi de l’environnement.
Exercices
Réponses physiologiques de différents groupes à l’hypoxie
3. L’étude des adaptations physiologiques à l’altitude grâce à la génomique
Comme nous venons de voir, les Tibétains n’ont pas une concentration supérieure en hémoglobine qui augmenterait leur performance de transport d’oxygène. En fait, ils en ont même moins que chez des individus des basses terres qui ont une réponse physiologique à l’hypoxie. Pourtant, leurs tissus ont besoin d’autant d’oxygène qu’une personne qui vit au niveau de la mer. Avec l’arrivée des approches de génomique dans les années 2000, des biologistes de plusieurs groupes de recherche se sont demandé à peu près toutes en même temps ce qui a changé dans le génome des Tibétains qui leur confère une meilleure performance face à l’hypoxie. Elles se sont dit qu’au lieu de chercher les traits un par un comme les physiologistes avaient fait jusqu’à ce jour, elles pourraient chercher dans tout le génome des Tibétains et trouver des gènes « candidats » qui porteraient des mutations qui seraient associées aux différences phénotypiques entre les groupes d’humains. Les résultats de ces différents efforts ont tous été publiés en 2010, une grosse année! Les biologistes ont cherché ce qui diffère dans le génome des Tibétains versus les Chinois Han, en supposant que certaines de ces différences génétiques expliquent leurs différences de réponse à l’hypoxie. Ils ont utilisé différentes approches d’analyse des génomes. Certaines équipes de recherche ont utilisé la cartographie génétique par association. L’analyse par association examine des populations particulières et tente de déterminer si la fréquence d’un allèle chez les individus avec un phénotype donné est différente de celle d’un ensemble d’individus qui n’ont pas ce phénotype. Ils ont donc comparé le génome entier de Tibétains et de Chinois Han pour trouver des régions du génome qui sont divergentes entre les deux groupes. Les différences génétiques peuvent être des mutations à un seul nucléotide et cette mutation peut être dans une région où il y a un gène (séquence codante) ou dans une région intergénique (où il pourrait y avoir une séquence régulatrice). La différence génétique pourrait aussi être sous forme de variants structuraux : par exemple un changement du nombre de copies d’un gène (duplication, délétion), ou une inversion. D’autres biologistes ont utilisé une approche de balayage génomique (« genome scan »). Elles ont cherché les séquences de gène qui sont sous sélection, en trouvant les gènes pour lesquels la fréquence d’un allèle pour un gène donné change considérablement entre les deux populations, jusqu’au point de devenir fixé.
Dans les deux types d’approches, elles ont trouvé des centaines de régions du génome qui diffèrent entre les Tibétains et les autres humains et ont choisi de réduire la liste en se concentrant sur des gènes qui sont connus pour être impliqués dans la physiologie. elles ont tous identifié la région qui contient le gène EPAS1 comme ayant une séquence nucléotidique différente chez la plupart des Tibétains versus les Chinois Han ou ayant une signature de sélection naturelle. Les gènes EPAS1 et EGLN1 ont montré les signaux les plus forts de balayage sélectif (« selective sweep »), car ils montrent des allèles (des « variants ») retrouvés à très haute fréquence chez les Tibétains (50–80 %), mais absents ou rares (<5 %) dans les humains des basses terres. Serez-vous étonnés d’apprendre que le gène EPAS1 des humains code pour la protéine HIF2-A, qui est centrale dans la cascade de réponse à l’hypoxie (figure 20.5)? Le gène EGLN1 fait aussi partie de cette cascade qui affecte de nombreuses fonctions liées à la réponse à l’hypoxie, incluant l’érythropoïèse, qui mène à la formation de globules rouges (figure 20.5) [19, 23-25]. Il semble que cette fonction pourrait être modifiée par les mutations découvertes chez les Tibétains. Mais de quelle façon?
4. Analyse expérimentale de la fonction du gène EPAS
Le premier paragraphe de la section 4 est adapté de [27].
Le gène EGLN1 code pour PHD2. Chez la plupart des humains, en normoxie, l’enzyme PHD2 exerce sa fonction d’hydroxylase oxygéno-dépendante et déclenche la dégradation des protéines HIF (HIF-1a et HIF-2a) (figure 20.5, panneau « normoxie »). Sous hypoxie, l’activité hydroxylase de cette enzyme est supprimée, ce qui entraine l’accumulation de HIF qui, comme facteur de transcription, peut activer l’expression de centaines de gènes cibles en aval et induire diverses réponses physiologiques, par exemple l’érythropoïèse. En contraste, la version tibétaine du gène EGLN1 qui code pour PHD2 porte deux mutations faux-sens spécifiques aux Tibétains, qui provoquent une dégradation accrue de la protéine HIF sous hypoxie, ce qui annule pratiquement l’augmentation de l’érythropoïèse médiée par HIF. Cela protègerait les Tibétains de la surproduction de globule rouge. Contrairement aux variants d’EGLN1, tous les variants d’EPAS1 identifiés sont situés dans les régions non codantes du génome (principalement dans les introns), ce qui suggère qu’ils n’affectent pas la forme de la protéine, mais peuvent plutôt affecter la régulation d’EPAS1 au niveau de sa transcription.
Les scientifiques ont sélectionné 32 variants tibétains dans le gène EPAS1 en sélectionnant ceux qui montraient une grande divergence d’allèles avec les humains des basses terres d’à travers le monde. À l’intérieur de cet haplotype tibétain, ils ont choisi une mutation à un nucléotide (« SNP ») pour laquelle 57 % des Tibétains ont un « A », mais qui est présent dans seulement 0,5 % des génomes de chinois Han, 3,2 % des génomes africains et aucun des génomes européens ou japonais. Une fois qu’une personne travaillant en génomique trouve une mutation qui est associée à un phénotype, elle doit aller plus loin si elle veut démontrer qu’il y a un lien causal entre les deux. Il faut étudier comment la fonction ou l’expression de la protéine codée par ce gène est affectée par la mutation et comment cela change le phénotype, qui lui affecte le fitness. Autrement dit, on doit chercher le lien fonctionnel. Les biologistes se sont demandé « Qu’est-ce qui est différent dans cet allèle du gène (EPAS1) chez les Tibétains? Comment la fonction est-elle affectée? » Les biologistes ont fait une étude sur des cellules endothéliales, car elles expriment habituellement EPAS et répondent à l’hypoxie. Ils ont introduit dans ces lignées cellulaires l’allèle tibétain ou l’allèle « original » trouvé chez les humains des basses terres et certains Tibétains. Comme ils avaient émis l’hypothèse que la mutation affecterait le niveau d’expression du gène chez les Tibétains, ils ont utilisé un test de gène rapporteur de luciférase pour mesurer l’expression du gène EPAS1 pour chaque allèle [27].
Vidéo sur l’utilisation d’un gène rapporteur de la luciférase. Elle vous expliquera très clairement ce qu’est un gène rapporteur de luciférase et la section « How to understand whether the promoter is strong or weak? » vous montrera exactement l’expérience que les biologistes ont faite pour étudier la variation génétique dans EPAS1.
Animated biology With arpan. (2022). Luciferase reporter assay | What is luciferase assay used for? | Applications of Luciferase assay [Vidéo]. Youtube. https://www.youtube.com/watch?v=ySZCdJz5Oac
Avec ce test, elles ont démontré que l’activité du promoteur de la version du gène avec l’allèle tibétain (« A ») était significativement plus faible que l’allèle sauvage T, retrouvée dans le reste du monde à plus haute fréquence (figure 20.6). La mutation est effectivement dans une région régulatrice et elle affecte négativement la transcription du gène EPAS1, qui est diminué de 30 % avec l’allèle tibétain.
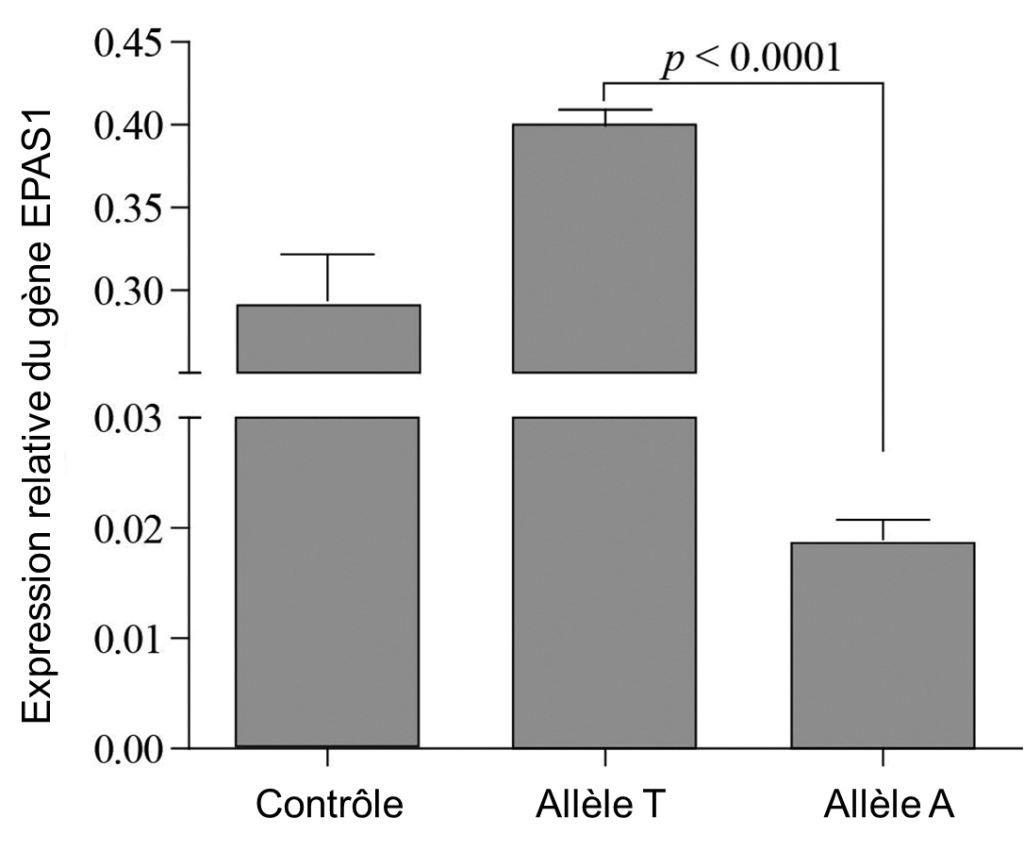
Les biologistes ont ensuite déterminé l’effet d’avoir l’haplotype tibétain (la séquence complète d’EPAS1 qui compte plusieurs mutations, pas seulement le SNP de T vers A) au niveau physiologique et organismique chez des souris transgéniques. En changeant la séquence de seulement un gène, les souris avaient toute une panoplie de changements physiologiques significatifs lorsqu’élevées pendant 4 semaines en hypoxie (équivalente à vivre à 5000 mètres) comparativement aux souris avec l’haplotype le plus fréquent chez les humains des basses terres. Elles avaient moins de perte de poids, une plus faible production d’érythropoïétine (EPO) et une concentration d’hémoglobine plus basse [27]. Cela récapitule le phénotype des Tibétains qui ne produisent pas autant de globules rouges en réponse à l’hypoxie que les humains des basses terres, cela en changeant la séquence d’un seul gène dans le génome. Il semble donc que la sélection naturelle ait favorisé une réponse moins grande à l’hypoxie du système de production de globules rouges et que le fait de ne pas en produire plus en hypoxie soit une adaptation des Tibétains à l’altitude. Cependant, il faut se rappeler que les Tibétains ont plusieurs autres différences physiologiques quand on les compare aux humains des basses terres, ce qui suggère que d’autres gènes sont aussi impliqués [27].
5. Variation génétique existante versus nouvelle mutation
Après la publication des nombreuses études montrant des différences génétiques entre les Tibétains et les Chinois Han, des biologistes spécialisés en génétique des populations se sont demandé si ces différences découlent de nouvelles mutations apparues chez les Tibétains après leur isolement des autres populations d’humain, qui ont ensuite été sélectionnées, ou si les mutations existaient déjà chez leur ancêtre et qu’elles ont augmenté en fréquence chez les Tibétains, car elles conféraient soudainement un avantage dans le nouvel environnement hypoxique en altitude. C’est important de savoir si c’est une nouvelle mutation qui est apparue chez les Tibétains et qui a été sélectionnée ou si c’était de la variation génétique existante (« standing genetic variation ») dans le génome, car cela nous aide à comprendre l’évolution des adaptations en général.
La chercheuse Emilia Huerta-Sanchez qui était alors à l’Université Berkeley a étudié cette question en collaboration avec des chercheurs du centre de génomique BGI [28]. Ils ont séquencé la région autour du gène EPAS1 chez 40 individus tibétains et 40 Chinois Han. Ils ont constaté que ce gène a un haplotype très inhabituel chez les Tibétains, car on trouve chez eux un « bloc » de mutations qu’on ne retrouve pas dans les autres génomes d’humain séquencés, sauf à très faible fréquence chez les Chinois Han. Un haplotype est un groupe d’allèles de différents loci situés sur un même chromosome et habituellement transmis ensemble [29]. Le fait que l’haplotype existe chez les Chinois Han, mais est vraiment plus fréquent chez les tibétains, supporte l’hypothèse qu’il y a eu de la sélection et de l’évolution, qu’on définit comme un changement de fréquence allélique entre les générations. Ils ont proposé que cette longue séquence ait été introduite dans le génome des ancêtres des Tibétains par flux génique à partir d’une population divergente. Mais laquelle?
N’ayant trouvé aucun autre génome d’humain moderne contenant cette séquence, les biologistes ont utilisé les informations sur le génome des Néandertaliens séquencé à l’aide d’ADN ancien trouvé dans des fouilles archéologiques, afin de déterminer si la séquence retrouvée chez des Tibétains provient des Néandertaliens. Ils ont découvert que non. Le seul génome qui a cet haplotype à part les Tibétains et une faible proportion de Chinois Han est celui séquencé à partir de l’ADN ancien d’un Denisovien, un groupe d’humains qui a divergé des humains modernes il y a au moins 200 000 ans. Des ancêtres des humains modernes et des Dénisoviens se sont donc reproduits et ainsi échangé du matériel génétique, il y a entre 46 000 et 48 000 ans [30]. L’haplotype d’EPAS1 des Dénisoviens était déjà présent dans le génome des individus qui étaient les ancêtres des Chinois Han et des Tibétains, ce qui représente un cas de variation génétique existante qui a été sélectionnée chez les Tibétains, plutôt qu’une nouvelle mutation qui est apparue. Les résultats de Emilia Huerta-Sanchez et de ses collaborateurs suggèrent que le mélange entre espèces d’hominidés qui ont cohabité un certain temps sur terre a résulté en de la diversité génétique qui a ensuite été sélectionnée lorsque ces humains ont fait face à de nouveaux environnements où cette mutation avait un effet sur le phénotype et le fitness. Son analyse suggère qu’il y a eu introgression d’ADN d’individus Denisoviens dans le génome des humains [28].
Exercices
Gènes EPAS1 et EGLN1
Cas appliqué
Entrevue avec Maud Demarest
Cette capsule vidéo présente une entrevue avec Maud Demarest, candidate au doctorat à l’Université Laval, associée à l’Institut universitaire de cardiologie et de pneumologie de Québec, à Québec. Ses travaux portent sur l’évolution de la capacité d’acclimatation à l’hypoxie chez des populations vivant en altitude ou non.
Vous pouvez activer les sous-titres en français.
Aubin-Horth, N. (2024). Écophysiologie évolutive: Maud Demarest. [Vidéo]. Youtube. CC-BY. https://youtu.be/LXcipx244GI?si=1NkUSKyUVNL-Yofi
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien. Transcription format word.
Résumé
Il existe diverses méthodes pour quantifier la tolérance à l’hypoxie des individus qui varient selon l’environnement et la question posée. La réponse à l’hypoxie d’une personne des basses terres est différente de celle observée chez les humains vivant en altitude. Les humains de différentes populations qui font face à l’altitude (Andes et Tibet) ont des adaptations physiologiques différentes. On peut étudier les bases génomiques de ces adaptations en cherchant des gènes candidats que l’on valide ensuite par des expériences de biologie moléculaire, cellulaire et de physiologie. Les Tibétains ont une réponse atténuée de la production de globules rouges face à l’hypoxie qui est causée par des mutations dans le gène EGLN1 et EPAS1 dont les produits sont impliqués dans la cascade HIF. Les haplotypes du gène EPAS1 retrouvés chez la majorité des Tibétains proviennent de l’introgression du génome de Dénisoviens il y a entre 46 et 48 milliers d’années.
Activité de révision
Exercices
Révision sur l’évolution de la réponse à l’hypoxie
Bibliographie
- Richards, J.G. (2009). Chapter 10 Metabolic and Molecular Responses of Fish to Hypoxia, in Fish Physiology, J.G. Richards, A.P. Farrell, and C.J. Brauner, Editors, Academic Press. p. 443-485. https://www.sciencedirect.com/science/article/pii/S1546509808000101.
- Rogers, N.J., M.A. Urbina, E.E. Reardon, D.J. McKenzie, and R.W. Wilson (2016). A new analysis of hypoxia tolerance in fishes using a database of critical oxygen level (P crit) [CC-BY]. Conserv Physiol. 4(1): p. cow012.
- Farrell, A.P. and J.G. Richards (2009). Chapter 11 Defining Hypoxia: An Integrative Synthesis of the Responses of Fish to Hypoxia, in Fish Physiology, J.G. Richards, A.P. Farrell, and C.J. Brauner, Editors, Academic Press. p. 487-503. https://www.sciencedirect.com/science/article/pii/S1546509808000113.
- Regan, M.D., M. Mandic, R.S. Dhillon, G.Y. Lau, A.P. Farrell, P.M. Schulte, B.A. Seibel, B. Speers-Roesch, G.R. Ultsch, and J.G. Richards (2019). Don’t throw the fish out with the respirometry water Journal of Experimental Biology. 222(6). https://doi.org/10.1242/jeb.200253.
- Robertson, C.E., P.A. Wright, L. Köblitz, and N.J. Bernier (2014). Hypoxia-inducible factor-1 mediates adaptive developmental plasticity of hypoxia tolerance in zebrafish, <i>Danio rerio</i> Proceedings of the Royal Society B: Biological Sciences. 281(1786): p. 20140637. https://royalsocietypublishing.org/doi/abs/10.1098/rspb.2014.0637.
- McDonnell, L.H. and L.J. Chapman (2015). At the edge of the thermal window: effects of elevated temperature on the resting metabolism, hypoxia tolerance and upper critical thermal limit of a widespread African cichlid Conservation Physiology. 3(1): p. cov050.
- Rees, B.B. and L.A. Matute (2018). Repeatable Interindividual Variation in Hypoxia Tolerance in the Gulf Killifish, Fundulus grandis [CC-BY-NC]. Physiol Biochem Zool. 91(5): p. 1046-1056.
- Bergstedt, J.H., T. Pfalzgraff, and P.V. Skov (2021). Hypoxia tolerance and metabolic coping strategies in Oreochromis niloticus [CC-BY]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 257: p. 110956. https://www.sciencedirect.com/science/article/pii/S1095643321000623.
- Chapman, L.J. and D.J. McKenzie (2009). Chapter 2 Behavioral Responses and Ecological Consequences, in Fish Physiology, J.G. Richards, A.P. Farrell, and C.J. Brauner, Editors, Academic Press. p. 25-77. https://www.sciencedirect.com/science/article/pii/S1546509808000022.
- Bickler, P.E. and L.T. Buck (2007). Hypoxia tolerance in reptiles, amphibians, and fishes: life with variable oxygen availability Annu Rev Physiol. 69: p. 145-70.
- Ramirez, J.M., L.P. Folkow, and A.S. Blix (2007). Hypoxia tolerance in mammals and birds: from the wilderness to the clinic Annu Rev Physiol. 69: p. 113-43.
- Schechter, G. (2011). Eastern Painted Turtle (Chrysemys picta picta) [CC-BY]. https://commons.wikimedia.org/wiki/File:Eastern_Painted_Turtle_(Chrysemys_picta_picta).jpg.
- Barathieu, G. (2013). Mother and baby sperm whale [CC-BY-SA]. https://en.wikipedia.org/wiki/File:Mother_and_baby_sperm_whale.jpg.
- Devereaux, M.E.M., K.L. Campbell, D. Munro, P.U. Blier, and M.E. Pamenter (2021). Burrowing star-nosed moles (Condylura cristata) are not hypoxia tolerant Journal of Experimental Biology. 224(19). https://doi.org/10.1242/jeb.242972.
- Liu, C., L.F. Zhang, and N. Li (2013). The specific expression pattern of globin mRNAs in Tibetan chicken during late embryonic stage under hypoxia Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 164(4): p. 638-644. https://www.sciencedirect.com/science/article/pii/S1095643312004527.
- Huang, S., L. Zhang, M.U. Rehman, M.K. Iqbal, Y. Lan, K. Mehmood, H. Zhang, G. Qiu, F. Nabi, W. Yao, M. Wang, and J. Li (2017). High altitude hypoxia as a factor that promotes tibial growth plate development in broiler chickens PLoS One. 12(3): p. e 0173698.
- Miller, C. (2022). Human Responses to High Altitude, in Human Biology. https://humanbiology.pressbooks.tru.ca/chapter/8-8-human-responses-to-high-altitude/.
- Willer, H. (2009). La Rinconada Peru [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:La_Rinconada_Peru.jpg.
- Bigham, A.W. and F.S. Lee (2014). Human high-altitude adaptation : forward genetics meets the HIF pathway [CC-BY-NC]. Genes & development. 28(20): p. 2189-2204.
- Beall, C.M. (2006). Andean, Tibetan, and Ethiopian patterns of adaptation to high-altitude hypoxia Integr Comp Biol. 46(1): p. 18-24.
- Beall, C.M., G.M. Brittenham, K.P. Strohl, J. Blangero, S. Williams-Blangero, M.C. Goldstein, M.J. Decker, E. Vargas, M. Villena, R. Soria, A.M. Alarcon, and C. Gonzales (1998). Hemoglobin concentration of high-altitude Tibetans and Bolivian Aymara Am J Phys Anthropol. 106(3): p. 385-400.
- Wu, T., X. Wang, C. Wei, H. Cheng, X. Wang, Y. Li, Ge-Dong, H. Zhao, P. Young, G. Li, and Z. Wang (2005). Hemoglobin levels in Qinghai-Tibet: different effects of gender for Tibetans vs. Han Journal of Applied Physiology. 98(2): p. 598-604. https://journals.physiology.org/doi/abs/10.1152/japplphysiol.01034.2002.
- Simonson, T.S., Y. Yang, C.D. Huff, H. Yun, G. Qin, D.J. Witherspoon, Z. Bai, F.R. Lorenzo, J. Xing, L.B. Jorde, J.T. Prchal, and R. Ge (2010). Genetic evidence for high-altitude adaptation in Tibet Science. 329(5987) : p. 72-5.
- Yi, X., Y. Liang, E. Huerta-Sanchez, X. Jin, Z.X. Cuo, J.E. Pool, X. Xu, H. Jiang, N. Vinckenbosch, T.S. Korneliussen, H. Zheng, T. Liu, W. He, K. Li, R. Luo, X. Nie, H. Wu, M. Zhao, H. Cao, J. Zou, Y. Shan, S. Li, Q. Yang, Asan, P. Ni, G. Tian, J. Xu, X. Liu, T. Jiang, R. Wu, G. Zhou, M. Tang, J. Qin, T. Wang, S. Feng, G. Li, Huasang, J. Luosang, W. Wang, F. Chen, Y. Wang, X. Zheng, Z. Li, Z. Bianba, G. Yang, X. Wang, S. Tang, G. Gao, Y. Chen, Z. Luo, L. Gusang, Z. Cao, Q. Zhang, W. Ouyang, X. Ren, H. Liang, H. Zheng, Y. Huang, J. Li, L. Bolund, K. Kristiansen, Y. Li, Y. Zhang, X. Zhang, R. Li, S. Li, H. Yang, R. Nielsen, J. Wang, and J. Wang (2010). Sequencing of 50 human exomes reveals adaptation to high altitude Science. 329(5987): p. 75-8.
- Bigham, A., M. Bauchet, D. Pinto, X. Mao, J.M. Akey, R. Mei, S.W. Scherer, C.G. Julian, M.J. Wilson, D. López Herráez, T. Brutsaert, E.J. Parra, L.G. Moore, and M.D. Shriver (2010). Identifying Signatures of Natural Selection in Tibetan and Andean Populations Using Dense Genome Scan Data PLOS Genetics. 6(9): p. e 1001116. https://doi.org/10.1371/journal.pgen.1001116.
- Hegasy, G. (2019). HIF Nobel Prize Physiology Medicine 2019 [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:HIF_Nobel_Prize_Physiology_Medicine_2019_Hegasy_ENG.png.
- Peng, Y., C. Cui, Y. He, Ouzhuluobu, H. Zhang, D. Yang, Q. Zhang, Bianbazhuoma, L. Yang, Y. He, K. Xiang, X. Zhang, S. Bhandari, P. Shi, Yangla, Dejiquzong, Baimakangzhuo, Duojizhuoma, Y. Pan, Cirenyangji, Baimayangji, Gonggalanzi, C. Bai, Bianba, Basang, Ciwangsangbu, S. Xu, H. Chen, S. Liu, T. Wu, X. Qi, and B. Su (2017). Down-Regulation of EPAS1 Transcription and Genetic Adaptation of Tibetans to High-Altitude Hypoxia [CC-BY-NC]. Molecular Biology and Evolution. 34(4): p. 818-830. https://doi.org/10.1093/molbev/msw280.
- Huerta-Sánchez, E., X. Jin, Asan, Z. Bianba, B.M. Peter, N. Vinckenbosch, Y. Liang, X. Yi, M. He, M. Somel, P. Ni, B. Wang, X. Ou, Huasang, J. Luosang, Z.X. Cuo, K. Li, G. Gao, Y. Yin, W. Wang, X. Zhang, X. Xu, H. Yang, Y. Li, J. Wang, J. Wang, and R. Nielsen (2014). Altitude adaptation in Tibetans caused by introgression of Denisovan-like DNA Nature. 512(7513): p. 194-7.
- Contributeurs de Wikipedia (2023). Haplotype, in Wikipédia, l’encyclopédie libre. https://fr.wikipedia.org/wiki/Haplotype.
- Zhang, P., X. Zhang, X. Zhang, X. Gao, E. Huerta-Sanchez, and N. Zwyns (2022). Denisovans and Homo sapiens on the Tibetan Plateau: dispersals and adaptations Trends Ecol Evol. 37(3): p. 257-267.

