10. L’étude des causes proximales
Introduction au sujet
Dans ce chapitre, nous discuterons de l’étude des causes proximales d’un trait et de comment nous étudions ces causes.
Objectifs spécifiques
À la fin de ce chapitre, vous serez en mesure de :
- Définir le concept de cause proximale.
- Appliquer les différentes façons d’étudier les causes proximales aux types de traits qui se prêtent à chaque méthode.
- Expliquer comment on peut mesurer un trait.
- Expliquer comment on peut localiser un trait.
- Expliquer comment on peut manipuler un trait.
- Expliquer dans quel contexte on peut faire une ablation et un remplacement.
- Expliquer le rôle d’un agoniste et d’un antagoniste.
- Expliquer dans quel contexte on peut utiliser une manipulation génétique.
Notions clés
1. Les causes proximales
Nous avons vu que lorsqu’on étudie une cause ultime, on se demande « quelle est la cause évolutive de l’existence de ce trait? ». Dans ce cas on cherche à comprendre l’agent de sélection et le lien entre le trait et le fitness. En biologie, nous pouvons aussi nous poser la question «comment ce trait se développe-t-il comme il est? ». Dans ce cas, on étudie la cause proximale (« proximale » veut dire « proche »). Les physiologistes sont intéressés par les causes proximales, car ils veulent comprendre quels mécanismes moléculaires, cellulaires et physiologiques engendrent les traits qui affectent la performance et permettent de répondre aux défis de l’environnement. Ils vont étudier comment une espèce de poisson peut vivre dans un lac hypoxique (dont le niveau d’oxygène est très bas), ce qui change durant l’acclimatation (ou non) à une augmentation de température chez deux espèces d’insectes, ou encore quels mécanismes permettent de survivre à une sècheresse chez un mammifère du désert. Ils vont aller scruter les niveaux d’organisation biologiques « en dessous » de l’organisme qui sont impliqués dans la réponse au défi, qui affectent la performance de l’organisme et, ultimement, son fitness.
En physiologie classique, pour répondre à cette question du « comment », les biologistes mesurent le taux d’utilisation de l’oxygène, le niveau du pH sanguin, la réponse cardiaque, le niveau de glucose sanguin, ou encore la quantité d’une hormone ou l’activité d’une enzyme. Avec toutes les nouvelles méthodes, les physiologistes ont de nouveaux outils à leur disposition. De plus en plus, les scientifiques qui travaillent en physiologie essaient de comprendre quels changements se font au niveau moléculaire et cellulaire et quels gènes sont impliqués dans le développement des traits physiologiques qui affectent la performance et qui sont des adaptations. Après avoir été beaucoup reliée à la physique et à la chimie du vivant, la physiologie moderne demande maintenant d’aussi utiliser nos connaissances de biologie cellulaire, de biologie moléculaire et de génétique. On peut par exemple étudier la présence du récepteur d’une hormone à la surface d’une cellule, l’acide aminé qui affecte l’affinité d’une enzyme, le niveau de centaines de métabolites simultanément, l’activité d’un neurone individuel, la quantité d’ARN messagers à différents moments d’une série temporelle, ou encore le niveau de méthylation de l’ADN.
Bien sûr, on s’intéresse aussi à l’évolution de ces causes proximales, donc on va souvent étudier les causes ultimes (l’agent de sélection, la cible de la sélection, etc.) conjointement avec les causes proximales.
Exercices
Vérifiez votre compréhension du concept de cause proximale avec ce quiz formatif.
Étudions-nous la cause proximale ou la cause ultime?
2. Comment on étudie les causes proximales
Pour dresser un portrait complet des processus qui affectent le phénotype de l’organisme lié à sa performance, nous devons avoir différentes informations. Le plus souvent, nous obtiendrons ces informations avec trois approches complémentaires. On peut mesurer un trait au niveau moléculaire, cellulaire ou physiologique. On peut par exemple mesurer la quantité d’une hormone ou le niveau du pH sanguin. On doit parfois localiser où se retrouve le trait qui nous intéresse, par exemple sur quel tissu se trouve un récepteur à un certain stade de vie, ou encore où est exprimé un ARN messager. Ces deux types d’information sont souvent cruciaux pour dresser un portrait de ce qui se passe dans l’organisme qui nous intéresse, surtout si on le compare à un autre organisme qui vit dans des conditions différentes. Cependant, pour savoir si ces traits moléculaires, cellulaires et physiologiques que l’on mesure et localise sont effectivement la cause de l’adaptation physiologique que l’on étudie, il faut manipuler ce trait expérimentalement. Par exemple, une biologiste mesure qu’une enzyme particulière a une activité plus élevée à basse température chez un individu comparativement à un autre, et qu’elle est localisée particulièrement dans un tissu comme les muscles. Elle doit maintenant savoir si cette variation dans l’activité de l’enzyme a un effet sur la physiologie musculaire qui affecterait par exemple la capacité de nage à basse température, ce qui augmenterait donc la performance de l’organisme lors d’une fuite face à un prédateur, ce qui aurait un effet sur le fitness via la survie. Ainsi, il faut manipuler le trait qu’on suppose être la cause proximale (l’activité de l’enzyme) et mesurer les effets de cette manipulation aux niveaux supérieurs d’organisation biologique (la performance et le fitness).
3. Mesurer un trait
Il y a de nombreuses méthodes à notre disposition pour mesurer un trait. Les méthodes changent vite et les technologies se raffinent. Inévitablement, une liste de méthodes deviendra éventuellement dépassée. On peut tout de même penser aux niveaux d’organisation biologiques qui seraient ciblés (moléculaires, cellulaires et physiologiques), certains traits qui correspondent à ces niveaux, ainsi que des méthodes qui sont en ce moment couramment employées (tableau 10.1).
Tableau 10.1 : méthodes actuelles pour mesurer différents traits
| Trait à mesurer | Méthode |
| Niveau d’une hormone | EIA, RIA |
| Niveau d’expression d’un gène (quantité d’ARN messager) | qRTPCR, RNA-seq |
| Quantité de protéines | Bradford, Western, HPLC, chromatographie en phase liquide couplée à la spectrométrie de masse, etc. |
| Niveau de méthylation de l’ADN | Traitement bisulfite et séquençage |
| Activité neuronale | fMRI, électrophysiologie |
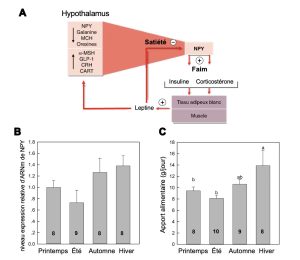
Prenons l’exemple de biologistes qui veulent déterminer comment certains paramètres environnementaux comme la température et la photopériode affectent la physiologie d’un petit mammifère arboricole d’Asie du Sud-Est, le toupaye de Belanger (Tupaia belangeri) (figure 10.1). Pour ce faire, ils exposent des individus à des conditions de température et de photopériode qui représentent les conditions des quatre saisons observées dans son aire de distribution et mesurent différents paramètres physiologiques.

Un des traits mesurés est l’expression du gène NPY (neuropeptide-Y), représentée par la quantité d’ARN messagers. Le neuropeptide codé par ce gène est impliqué dans la boucle de rétrocontrôle de la faim. En effet, il a déjà été démontré chez d’autres espèces qu’une augmentation de la quantité de ce neuropeptide augmente la sensation de faim et l’apport alimentaire. Les scientifiques émettent l’hypothèse que ce neuropeptide a la même fonction chez le toupaye et prédisent qu’étant donné que les individus s’alimentent d’avantage en conditions hivernales, on devrait observer une augmentation de l’expression de NPY en hiver. Ils mesurent des variations d’expression du neuropeptide selon la saison (mais il n’y a pas de différences statistiquement significatives) ainsi que des différences significatives d’apport alimentaire (en gramme par jour) selon la saison (figure 10.2).
4. Localiser un trait
Parfois on doit savoir où se passe un processus et quel tissu est affecté. Pour ce faire, on veut localiser un produit important dans un système physiologique. On cherche dans quel tissu on le trouve, par exemple, quelle région du cerveau est active, ou sur quel type de cellules on retrouve un récepteur. Il existe différentes techniques pour localiser (tableau 10.2).
Tableau 10.2 : méthodes actuelles pour localiser différents traits
| Trait à localiser | Méthode |
| Expression de gène | Hybridation in situ avec une sonde marquée aux isotopes radioactifs ou au fluorescent |
| Protéine | Immunohistochimie |
| Récepteur d’une hormone | Utilisation d’un ligand fluorescent |
| Site de l’activation neuronale | Imagerie par résonance magnétique fonctionnelle |
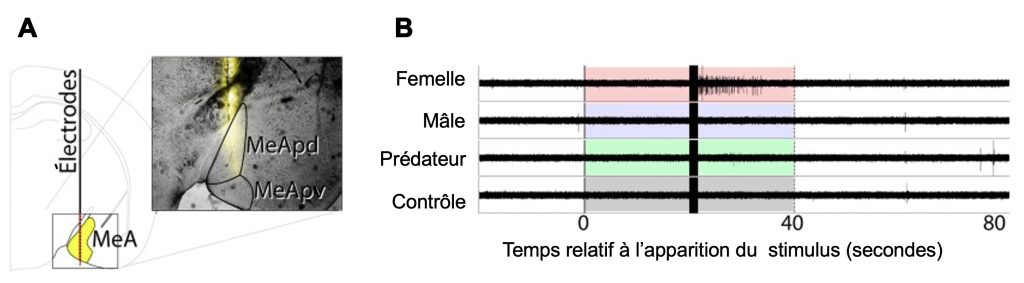
L’activité neuronale peut être localisée de façon très précise. Par exemple, la réponse neuronale d’animaux à différents stimulus peut être localisée à l’aide d’électrodes multiples placées près des régions d’intérêt (figure 10.3). La distribution des électrodes permet de déterminer de façon fine la localisation spatiale des neurones activés et de ceux qui ne le sont pas.
5. Manipuler un trait
Une fois qu’on a établi qu’une enzyme est en plus grande quantité quand un individu fait face à l’hypoxie, ou qu’un récepteur est localisé sur un tissu spécifique chez un individu qui a de meilleures capacités thermogéniques, on veut habituellement savoir si cette corrélation entre les deux indique qu’une variable affecte l’autre, c’est-à-dire qu’il y a un lien de causalité. En effet, on pourrait voir que ces traits sont associés, mais qu’il n’y a pas de lien de causalité, peut-être parce que les deux traits sont tous deux affectés par un troisième trait que nous n’avons pas mesuré, ou simplement dû au hasard.
Qu’est-ce qu’on peut faire comme expérience pour voir s’il y a un lien fonctionnel entre la quantité d’une molécule (hormone, enzyme, un canal ionique, de l’ATP) et un trait physiologique? On fait une analyse fonctionnelle avec une manipulation. Par lien fonctionnel, on veut dire que l’effet de la présence d’un trait (une hormone, une enzyme, un transporteur membranaire) est la cause d’un autre trait observé qui affecte la performance (une meilleure capacité à vivre en hypoxie, à faire face à la sècheresse). C’est pourquoi une manipulation peut nous informer sur cette fonction.
Traditionnellement, les physiologistes des animaux ont utilisé ce type de manipulation pour dessiner les contours généraux de la fonction d’un organe d’un animal, comme les gonades (reproduction), le pancréas (production d’insuline), la rate (globules rouges), les reins (balance osmotique et pH sanguin). Les physiologistes des plantes ont aussi utilisé ces approches de manipulation pour comprendre le fonctionnement de la photosynthèse, des échanges avec le milieu, ainsi que les processus physiologiques qui affectent l’allocation d’énergie vers la croissance, les réserves énergétiques ou la reproduction.
Il y a trois grandes catégories de manipulation qui peuvent nous être utiles : l’ablation et le remplacement, l’utilisation d’agonistes et d’antagonistes, ainsi que la manipulation génétique.
5.1. Ablation et remplacement
L’ablation consiste à enlever des cellules, un tissu, ou un organe entier. Le remplacement utilise l’approche inverse, en ajoutant des cellules, un tissu ou un organe. On peut enlever et remettre une glande endocrine, comme aux débuts de l’endocrinologie (l’étude des hormones), afin d’esquisser la fonction de cette glande. Cette approche fonctionne chez les animaux mais aussi chez les plantes. On peut utiliser l’ablation et le remplacement en neurobiologie et ainsi définir les fonctions d’une partie du cerveau chez un vertébré, d’un ganglion nerveux chez un insecte, ou encore de connexions nerveuses entre différents organes.
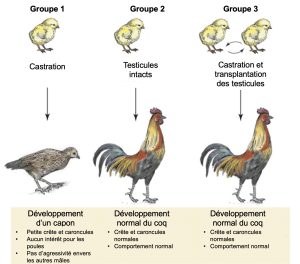
La première expérience en endocrinologie a été faite par ablation et remplacement. Au 19e siècle, un biologiste nommé Berthold a utilisé la castration chez des coquelets afin d’étudier l’effet de cette manipulation sur la physiologie et le comportement (figure 10.4). Il souhaitait comprendre le lien fonctionnel entre le produit provenant des gonades (il ne savait pas si le signal des gonades était nerveux ou passait par la circulation sanguine) et la reproduction des mâles. Il a ainsi démontré un lien fonctionnel direct entre la présence de gonades et le phénotype sexuel mâle.
Une grande découverte pour la physiologie, celle du rôle de l’insuline, a aussi commencée avec une expérience d’ablation et de remplacement. Les chercheurs qui travaillaient sur le diabète (Banting et Best) se sont demandé quel serait l’effet d’une ablation du pancréas d’un chien sur son taux de sucre sanguin. Ils voulaient savoir ce qui change dans sa physiologie. Après ablation, ils ont observé que le taux de sucre sanguin ne restait plus à l’intérieur d’une certaine gamme de valeur pour cette espèce et que l’homéostasie était rompue. Lorsqu’ils ont remplacé le pancréas par des extraits de pancréas chez le chien, le taux de sucre a été quelque peu stabilisé. Ce fut la première indication que le pancréas était impliqué dans la glycémie et par extension dans le diabète de type 1.
Il est possible de cibler l’ablation de sections précises du système nerveux et même de neurones individuels avec des techniques récentes. Par exemple, l’utilisation de laser permet de cibler des régions très précises chez les vertébrés. Des neurophysiologistes ont ainsi réussi à détruire un neurone individuel, la cellule de Mauthner, chez le poisson-zèbre (Danio rerio, figure 10.5).

Il a été proposé que ce neurone géant du système nerveux central est impliqué dans la réponse de fuite chez les poissons, mais il était difficile de démontrer cette fonction avant que l’ablation très précise de ce neurone unique ne devienne possible avec l’apparition de nouvelles technologies, ici représentée par un article scientifique publié en 2020. Des neurophysiologistes ont utilisé une approche de dégradation du soma et de l’axone de ce neurone géant initiée par un traitement au laser très précis (voir vidéo ci-bas).
Expérience d’ablation d’un neurone chez le poisson-zèbre. Une vidéo prise par fluorescence d’une larve de poisson-zèbre. Un renflement (le soma) qui se termine en forme mince et pâle (l’axone) est visible de chaque côté du poisson, ce qui représente les cellules de Mauthner. À mesure que le temps passe, la cellule de Mauthner gauche qui a été traitée au laser fluoresce de moins en moins. 44 heures plus tard après avoir fait l’ablation du côté gauche du poisson, on ne voit plus de soma du côté gauche de la tête du poisson et son axone qui longe l’animal du côté droit est aussi éliminé. Adapté de [6].
Hecker et al. (2020). Movie S1 [Vidéo]. Glencoe Software. CC-BY-NC-ND. http://movie-usa.glencoesoftware.com/video/10.1073/pnas.1918578117/video-1
Les neurophysiologistes ont testé la réponse de fuite des larves traitées et témoins et ont déterminé que l’ablation du neurone contralatéral (la lésion est du côté opposé à la direction de fuite) élimine entièrement la réponse de fuite des poissons [6]. Les neurophysiologistes ont ensuite vérifié si ce changement de performance créé par l’absence de ce neurone affectait le fitness des individus en les exposant à la prédation d’une larve de libellule dans des conditions similaires au milieu naturel. En effet, les larves de libellules sont des prédateurs des larves de poisson et elles se comportent de la même façon en laboratoire, ce qui permet de tester le lien entre la performance de la larve de poisson (mesurée par la vitesse de fuite) et le fitness. La différence de survie était significative entre les deux traitements durant une expérience d’une durée de 7 heures.
Les deux vidéos suivantes illustrent un test de prédation similaire à celui utilisé dans l’expérience. Dans la première vidéo, le poisson échappe au prédateur, mais dans la deuxième vidéo sa réponse de fuite n’est pas assez rapide.
Test de prédation par une larve de libellule sur une larve de poisson-zèbre filmée à haute vitesse et présenté au ralenti. L’individu échappe au prédateur durant l’interaction qui dure environ 50 millisecondes. Adapté de [6].
Hecker et al. (2020). Movie S3 [Vidéo]. Glencoe Software. CC-BY-NC-ND. http://movie-usa.glencoesoftware.com/video/10.1073/pnas.1918578117/video-3
Test de prédation par une larve de libellule sur une larve de poisson-zèbre filmée à haute vitesse et présenté au ralenti. L’individu est capturé par le prédateur durant l’interaction qui dure environ 70 millisecondes. Adapté de [6].
Hecker et al. (2020). Movie S4 [Vidéo]. Glencoe Software. CC-BY-NC-ND. http://movie-usa.glencoesoftware.com/video/10.1073/pnas.1918578117/video-3
5.2. Agoniste et antagoniste
Après les premières avancées réalisées grâce à l’approche de l’ablation et du remplacement, les avancées en biochimie ont permis d’extraire de grandes quantités d’hormones d’échantillons de tissus. Les biologistes ont ensuite pu injecter ces produits pour quantifier les effets sur l’organisme d’intérêt, comme une plante ou un animal, et commencer à décrire la fonction de ces hormones. On peut par exemple vouloir savoir quel trait est affecté si on ajoute une hormone ou si on bloque son action et comment cela est relié à la dose utilisée. De cette façon, on peut jouer plus finement avec les niveaux de la molécule d’intérêt que simplement comparer les effets de l’absence ou la présence de celle-ci. Par exemple, si on donne de l’insuline à un animal et qu’on mesure son niveau de sucre dans le sang avant et après l’ajout de l’hormone, ça nous permet de déterminer la fonction de l’insuline dans la régulation de l’homéostasie du glucose sanguin. Plus tard, on a pu synthétiser des versions synthétiques de ces molécules. On peut ainsi moduler la quantité donnée en fonction de l’effet désiré.
Les produits qui activent le récepteur d’une hormone, que ce soit l’hormone elle-même ou un produit synthétique qui a le même effet au niveau cellulaire, s’appellent des agonistes (figure 10.6). Ces agonistes sont souvent utilisés en médecine. Par exemple, l’hormone de croissance qui est utilisée chez les enfants qui ont des retards de croissance est un agoniste synthétique qui agit sur le récepteur de cette hormone.
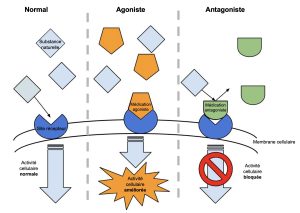
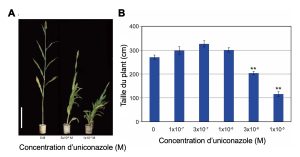
On peut aussi bloquer l’action de la molécule qui nous intéresse, qui est souvent une hormone. On utilise alors un antagoniste, qui se lie au récepteur de la molécule d’intérêt mais n’active pas sa fonction de signalisation (figure 10.6). L’hormone ne peut plus envoyer son signal à la cellule, car les récepteurs sont occupés par l’antagoniste. On peut ensuite mesurer ce qui arrive au trait d’intérêt. Par exemple, on peut bloquer l’action sur la croissance des plantes de l’hormone gibbérelline avec différents produits synthétiques antagonistes. L’application des antagonistes limite la croissance de la plante, ce qui est utilisé en horticulture pour obtenir des plants fleuris et denses et en science fondamentale pour comprendre la physiologie des plantes dans différentes conditions (figure 10.7).
5.3. Manipulation génétique
Une autre façon de manipuler une molécule, quelle qu’elle soit, est de manipuler sa production au niveau génétique (tableau 10.3). On peut ainsi cibler n’importe quelle variable au niveau moléculaire ou cellulaire. Il y a plusieurs façons de créer un mutant, ce qui peut complètement enlever le gène d’intérêt. On peut aussi échanger un allèle pour un autre, ajouter un gène provenant d’une autre espèce, ou changer son nombre de copies. L’activité du gène peut aussi être manipulée à un moment précis, par exemple par la température qui active ou bloque l’activité du gène, ou par la lumière, avec l’optogénétique. Dans tous les cas, on peut ensuite mesurer les effets sur l’organisme d’intérêt.
Tableau 10.3 : méthodes actuelles de manipulation génétique
| Méthodes de manipulation génétique |
| RNA interference et RNA silencing |
| Optogénétique |
| Mutants (incluant CRISPR-Cas) |
Cette vidéo présente une entrevue avec deux biologistes, Christiane Nüsslein-Volhard et Eric Wieschaus, qui ont été les premiers à créer des drosophiles mutantes afin de comprendre la fonction de différents gènes dans le développement. Dans cette vidéo, ils expliquent tout l’historique de leur recherche et de leur travail en collaboration et c’est fascinant. Ils ont obtenu le Prix Nobel de Physiologie et Médecine de 1995.
Entrevue avec Christiane Nüsslein-Volhard et Eric Wieschaus
iBiology Science Stories. (2015). Eric Wieschaus and Christiane Nüsslein-Volhard: Collaborating to Find Developmental Genes [Vidéo]. Youtube. https://www.youtube.com/watch?v=GmQ9eI1vdGM&ab_channel=iBiologyScienceStories
Cas appliqué
Entrevue avec Verônica Angélica Alves
Cette capsule vidéo présente une entrevue avec Verônica Angélica Alves, étudiante au doctorat en Sciences de l’eau dans le laboratoire de Valérie Langlois à l’INRS à Québec. Ses travaux portent sur l’étude des causes proximales du comportement à la maîtrise et de la reproduction au doctorat. Vous pouvez activer les sous-titres en français.
Aubin-Horth, N. (2024). Écophysiologie évolutive: Verônica Angélica Alves. [Vidéo]. Youtube. CC-BY. https://youtu.be/hdsVO1IKLno?si=prNXcyZ7PwBcxTN7
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien. Transcription Alves en format word.
Résumé
L’étude des causes proximales vise à comprendre les mécanismes moléculaires, cellulaires et physiologiques qui affectent la valeur d’un trait. Il y a plusieurs types d’approches qui peuvent être utilisées pour étudier les causes proximales.
Activité de révision
Exercices
Révision sur l’étude des causes proximales
Bibliographie
- Onkelramirez1 (2017). Tupaia belangeri [License Pixabay].
- Zhang, L., F. Yang, Z.-k. Wang et W.-l. Zhu (2017, 2017/02/01). Role of thermal physiology and bioenergetics on adaptation in tree shrew (Tupaia belangeri): the experiment test [CC-BY]. Scientific Reports, 7(1), 41352.
- Bergan, J.F., Y. Ben-Shaul et C. Dulac (2014). Sex-specific processing of social cues in the medial amygdala [CC-BY]. Elife, 3, 22.
- Bass, A.H. (2016). Hearing and Hormones: Paying Homage to the Comparative Approach. [CC-BY] Springer International Publishing. 1-14p.
- Azul (2005). zebrafish [CC-BY].
- Hecker, A., W. Schulze, J. Oster, D.O. Richter et S. Schuster (2020). Removing a single neuron in a vertebrate brain forever abolishes an essential behavior [CC-BY-NC-ND]. Proceedings of the National Academy of Sciences, 117(6), 3254-3260.
- Dolleyj (2014). Agonist & Antagonist [CC-BY].
- Ordonio, R.L., Y. Ito, A. Hatakeyama, K. Ohmae-Shinohara, S. Kasuga, T. Tokunaga, H. Mizuno, H. Kitano, M. Matsuoka et T. Sazuka (2014). Gibberellin deficiency pleiotropically induces culm bending in sorghum: an insight into sorghum semi-dwarf breeding [CC-BY]. Scientific Reports, 4(1), 5287. https://doi.org/10.1038/srep05287

