19. La régulation des systèmes physiologiques face à l’hypoxie
Introduction
Dans ce chapitre, nous aborderons le défi que cause le manque d’oxygène pour l’homéostasie et la survie et comment nos systèmes physiologiques y répondent. Lorsque la pression partielle d’oxygène est faible, soit dans l’environnement, soit dans les tissus d’un organisme, on parle d’hypoxie. Nous verrons d’abord les différentes causes possibles de l’hypoxie. Nous verrons ensuite les différents rôles de la respiration et comment celle-ci est régulée. Nous verrons comment le système sensoriel interne procure des informations aux circuits respiratoires du cerveau sur les niveaux d’oxygène et de CO2 sanguin, ce qui entraine une modification de la ventilation. Nous verrons comment le pH sanguin et les niveaux de CO2 sont reliés. Nous verrons aussi comment le système circulatoire s’active pour rétablir l’homéostasie à court terme face à une baisse du taux d’oxygène sanguin. Finalement, nous verrons que l’acclimatation à l’hypoxie est possible et que les niveaux d’oxygène durant le développement peuvent affecter la tolérance à l’hypoxie plus tard dans la vie, grâce à la plasticité phénotypique.
Objectifs spécifiques
À la fin de ce chapitre, vous serez en mesure de :
- Définir l’hypoxie
- Expliquer les différentes causes de l’hypoxie
- Expliquer le rôle de la respiration
- Expliquer le fonctionnement de l’arc réflexe de la respiration
- Décrire les fonctions des groupes neuronaux formant les circuits respiratoires
- Identifier les rôles des mécanorécepteurs dans la régulation de la ventilation.
- Identifier les rôles des centres cérébraux supérieurs dans la régulation de la ventilation.
- Identifier les rôles des chémorécepteurs périphériques et centraux dans la régulation de la ventilation.
- Connaitre les éléments et le fonctionnement de la réponse du système respiratoire face à l’hypoxie aigüe
- Expliquer la relation entre le système respiratoire et le pH sanguin
- Expliquer l’équation illustrant la balance entre le bicarbonate, la pression partielle de CO2 et le pH sanguin
- Interpréter un diagramme de Davenport illustrant la balance entre le bicarbonate, la pression partielle de CO2 et le pH sanguin
- Décrire la réponse du système circulatoire face à l’hypoxie aigüe
- Décrire la réponse à court terme et l’acclimatation à l’hypoxie
- Décrire la plasticité développementale en présence d’hypoxie en début de vie
Notions clés
- L’hypoxie
- Les causes de l’hypoxie
- Hypoxie environnementale
- Effet de l’utilisation de l’oxygène par les organismes aquatiques
- L’altitude
- Les environnements souterrains
- Hypoxie interne
- Le fonctionnement du système respiratoire
- Le rôle de la respiration
- L’arc réflexe du rythme respiratoire
- Les circuits respiratoires
- Le groupe respiratoire dorsal
- Le groupe respiratoire ventral et le générateur de rythme
- Le groupe respiratoire pontin
- Apports d’information aux circuits respiratoires
- Les mécanorécepteurs
- Les centres cérébraux supérieurs
- Les chémorécepteurs
- Les chémorécepteurs centraux
- Les chémorécepteurs périphériques
- La réponse du système respiratoire à l’hypoxie aigüe
- La balance entre le pH, le bicarbonate et le CO2
- Le diagramme de Davenport
- L’alcalose respiratoire
- La réponse du système circulatoire à l’hypoxie aigüe
- Effet sur l’hématocrite et l’hémoglobine
- Effet sur le rythme et le débit cardiaques et la vasoconstriction
- Réponse à court terme et acclimatation à l’hypoxie
- Plasticité développementale et hypoxie
1.L’hypoxie
La section 1 est adaptée de [1-3].
L’oxygène est l’élément le plus abondant sur Terre et, après l’hydrogène et l’hélium, le troisième élément le plus abondant dans l’univers. À température et pression standard, deux atomes de l’élément se lient pour former du dioxygène, un gaz diatomique incolore et inodore de formule O2. L’O2 constitue actuellement 20,95 % de l’atmosphère terrestre, bien que cette situation ait considérablement varié au fil du temps. Toutes les plantes, tous les animaux et tous les champignons ont besoin d’oxygène pour la respiration cellulaire, qui extrait de l’énergie par la réaction de l’oxygène avec des molécules dérivées des aliments et produit du dioxyde de carbone comme déchet.
Si un niveau normal d’oxygène est observé dans un environnement, on le caractérise comme normoxique. Lorsque le niveau d’oxygène est bas dans l’environnement, on parle d’hypoxie environnementale. Il faut noter qu’on peut aussi utiliser le terme « hypoxie » pour référer à un faible niveau d’O2 à l’intérieur des tissus d’un organisme. En absence d’oxygène, on parle d’anoxie. L’O2 est 30 fois plus soluble dans l’air que dans l’eau pour une même pression partielle de ce gaz. Cette différence se reflète lorsqu’on contraste la physiologie des organismes qui vivent en milieu terrestre avec ceux vivant en milieu aquatique. Dans les systèmes terrestres, les organismes font face à l’hypoxie dans des conditions spécifiques (par exemple, en altitude où la pression partielle d’O2 est plus faible ou sous terre chez les organismes fouisseurs). Dans les systèmes aquatiques, les organismes font plus souvent face à l’hypoxie. On définit si un système aquatique est normoxique ou hypoxique en calculant la saturation en oxygène, qui est généralement exprimée en pourcentage de la quantité maximale d’oxygène qui peut théoriquement se dissoudre dans l’eau, qui est fonction de la température et de la salinité de cet environnement (ces deux variables affectant négativement la solubilité de l’oxygène dans l’eau, figure 19.1). On utilise aussi souvent la pression partielle en oxygène du milieu pour le qualifier de normoxique ou hypoxique.
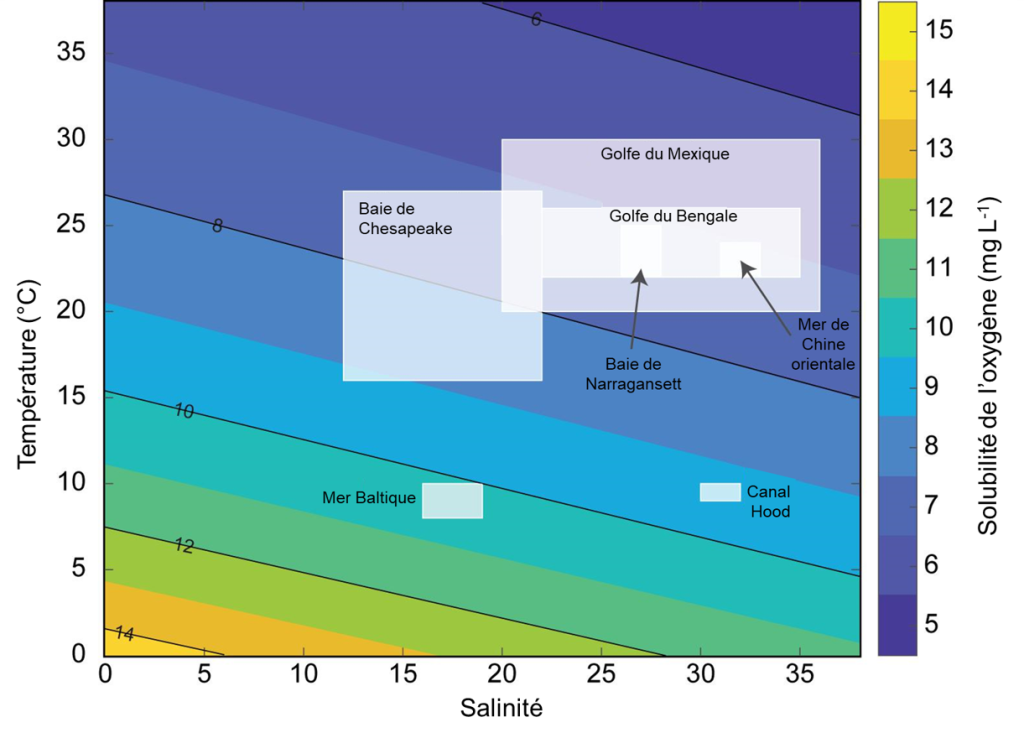
Un système aquatique d’eau douce bien aéré, avec de l’eau en mouvement comme une rivière, a une saturation en oxygène de 100%. Il peut même devenir hyperoxique si la production primaire est élevée, car la photosynthèse des algues résulte en la production d’oxygène, ce qui augmente la saturation au-dessus de 100%. Un système aquatique à faible saturation d’O2 – comprise entre 1 et 30 % de saturation – est appelé hypoxique. Cette grande gamme de valeurs pour déterminer qu’un environnement est hypoxique résulte du fait que l’hypoxie est souvent définie comme étant le niveau d’O2 en dessous duquel 50% des individus d’une population ne peuvent survivre, mais ce niveau est très variable entre les espèces et les stades de vie, ainsi que selon la durée de l’exposition. Par exemple, une synthèse de la littérature chez des animaux marins benthiques (poissons, bivalves, crustacés, gastropodes) suggère que le seuil moyen d’hypoxie varie entre 0 et 8,6 mg d’O2/L pour ces groupes [5]. Les scientifiques suggèrent d’utiliser un seuil de 4,6 mg d’O2/L, plutôt que celui de 2 mg/L utilisé par des agences gouvernementales et des physiologistes pour désigner des environnements dangereux pour la survie. Ce seuil de 4,6 mg d’O2/L permettrait de conserver 90% des espèces, avec une mortalité significative pour « seulement » 10% d’entre elles. Cette synthèse de la littérature démontre que les résultats des études en physiologie sont déterminants pour choisir les seuils utilisés en conservation environnementale et qu’une meilleure compréhension de la diversité physiologique a des conséquences appliquées [5].
2. Les causes de l’hypoxie
Les causes de l’hypoxie sont multiples. On peut diviser l’hypoxie en deux grandes catégories : l’hypoxie environnementale et l’hypoxie interne. Ces manques de disponibilité d’oxygène entrainent habituellement une réponse des systèmes physiologiques de l’organisme.
2.1 Hypoxie environnementale
Une cellule peut faire face à un faible niveau d’oxygène parce que le niveau d’oxygène dans l’environnement de l’organisme est bas.
2.1.1 Effet de l’utilisation de l’oxygène par les organismes aquatiques
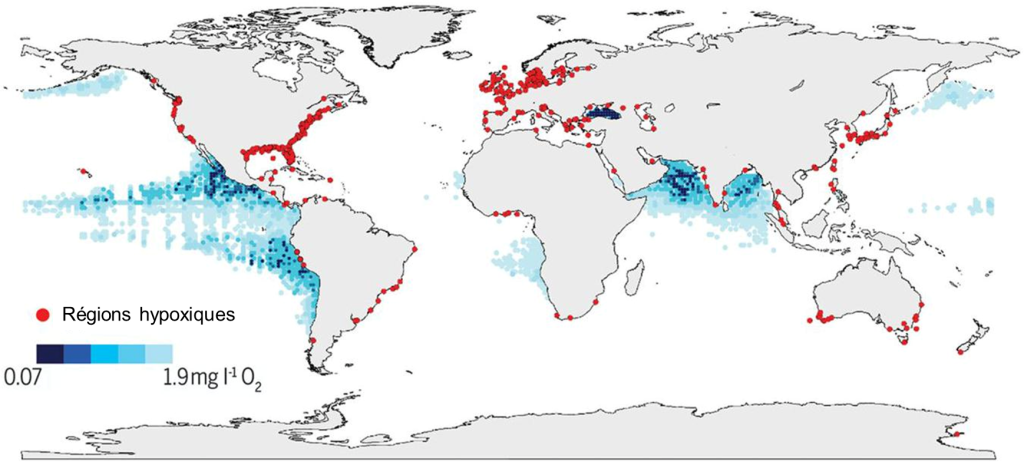
En milieu aquatique, la disponibilité de l’O2 est plus basse que dans l’air. De nombreux organismes utilisent l’oxygène dissout dans leurs processus métaboliques, incluant des microorganismes qui décomposent la matière, ce qui entraine une baisse de l’O2 disponible si aucun nouvel apport ne se produit. Une telle situation peut arriver par exemple dans un lac en milieu tempéré. L’augmentation des apports en éléments nutritifs d’origine humaine et l’eutrophisation des eaux que nous vivons depuis des décennies affectent la disponibilité en oxygène de l’environnement au-delà de la déplétion observée avant les effets anthropiques. De plus en plus de régions côtières du monde ont des eaux sous la barre des 2,0 mg/L d’O2 (figure 19.2). De plus, la température de l’eau réduit la saturation en oxygène, ce qui peut aggraver l’hypoxie créée par l’eutrophisation si la température augmente en raison des changements climatiques.
Les biologistes et océanographes de l’Institut Maurice-Lamontagne étudient les changements des conditions abiotiques de l’embouchure du fleuve Saint-Laurent et du golfe (figure 19.3). Ils ont créé des indices de qualité de l’habitat pour différentes variables. Pour l’oxygène, ils ont comme limite un taux d’oxygène dissout de 30% du taux de saturation au-dessous duquel ils considèrent que la qualité de l’habitat n’est plus bonne (elle est classifiée comme « intermédiaire »). Si on descend à moins de 10%, on parle de conditions mauvaises. Entre 2008 et 2017, l’indice d’habitat a été « intermédiaire-mauvais », avec des niveaux d’oxygène dissout atteignant jusqu’à seulement 17% du taux de saturation [7]. Cette détérioration est due à des changements dans les courants océaniques liés aux changements climatiques, qui font que cet habitat reçoit plus d’eau provenant du Gulf Stream, qui est plus faible en oxygène dissout et plus chaud que le courant du Labrador qui était autrefois dominant [7]. La pollution agricole en amont dans le fleuve entraine aussi une augmentation de la matière organique qui se dépose en aval dans l’estuaire. La décomposition bactérienne de cette matière utilise l’oxygène présent dans l’eau et amplifie l’hypoxie du milieu.

Un autre exemple d’environnement où on retrouve de l’hypoxie est la zone intertidale des environnements marins. Celle-ci est sujette à des variations d’oxygène avec les marées. En effet, une zone intertidale est définie comme la zone qui est couverte par la marée haute et découverte à marée basse. Suivant le mouvement des marées, cette zone passe donc d’habitat aquatique à semi-terrestre avec des pochettes aquatiques isolées. Durant les marées basses, ces mares temporaires isolées peuvent être hypoxiques ou même devenir anoxiques dû à l’utilisation de tout l’oxygène présent par les organismes qui y vivent et qui ne peuvent se déplacer [9].
Certains organismes aquatiques passent des phases spécifiques de leur vie sous des bas niveaux d’oxygène, par exemple l’hiver sous la glace dans un plan d’eau où la dégradation de la matière organique couplée à une absence d’apport d’oxygène causée par la surface glacée résulte en une baisse de la saturation en oxygène, allant même jusqu’à l’anoxie. C’est le cas de reptiles et de poissons des milieux tempérés en eau douce [10].
Les milieux d’élevage, particulièrement pour les environnements aquatiques comme l’aquaculture de poissons qui ont une forte densité de population, peuvent présenter des défis pour les organismes qui y sont cultivés. Les physiologistes s’intéressent donc aussi à la tolérance à l’hypoxie et ses effets sur la physiologie, la performance et le fitness pour des raisons appliquées [11].
2.1.2 L’altitude
La section 2.1.2 est adaptée de [12].
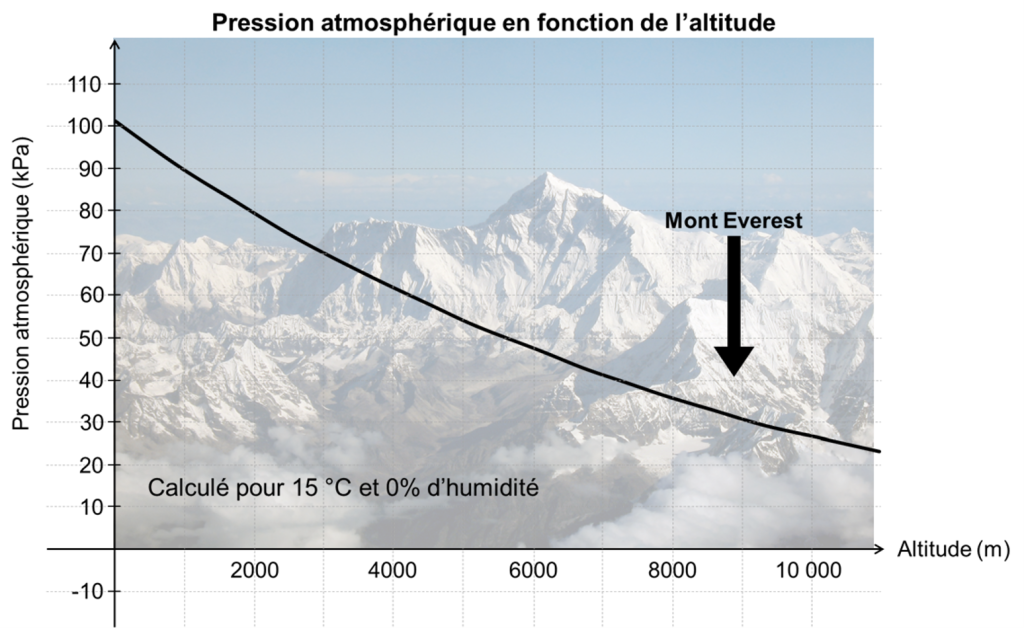
Une cellule peut manquer d’oxygène parce que la pression partielle d’oxygène est faible dans l’environnement terrestre dû à l’altitude. On peut penser par exemple à un humain qui monte en altitude dans le but de gravir le mont Everest. En effet, à mesure que l’on s’élève au-dessus du niveau de la mer, la densité de l’air diminue de façon exponentielle (figure 19.4), diminuant environ de moitié tous les 5 500 m d’altitude. La composition de l’air atmosphérique étant quasiment constante en dessous de 80 km, du fait de l’effet de mélange continu des conditions météorologiques, la concentration d’oxygène dans l’air diminue avec l’altitude au même rythme que la baisse de pression atmosphérique. Par conséquent, pour respirer la même quantité d’oxygène par minute, un organisme doit inhaler un volume d’air par minute proportionnellement plus élevé en altitude qu’au niveau de la mer.
2.1.3 Les environnements souterrains
Les organismes fouisseurs font aussi face à une pression partielle d’oxygène plus faible qu’à la surface. C’est le cas entre autres du rat-taupe nu, une espèce de rongeur qui vit en groupes sociaux dans des cavités et tunnels souterrains où la grande quantité d’individus diminue les niveaux d’oxygène disponibles, quoi que de façon intermittente selon l’endroit où se trouve l’animal dans la colonie [15]. Pour en apprendre plus sur le rat-taupe nu et comment les physiologistes l’étudient, vous pouvez visionner ce reportage de vulgarisation scientifique.
2.2 Hypoxie interne
Une cellule peut aussi manquer d’oxygène pour une tout autre raison : parce que l’apport sanguin en oxygène est faible. Cela peut être dû à une hémorragie, ce qui crée une baisse du volume sanguin en circulation et ainsi de l’oxygène apporté aux tissus de cette région du corps. Une ischémie, soit un blocage de la circulation sanguine vers un tissu ou un membre, peut aussi causer une hypoxie dans la région touchée. Cela peut aussi être dû à des problèmes d’échange gazeux dans les poumons, comme de l’asthme, une pneumonie, de l’emphysème ou un œdème pulmonaire, ou à un manque de globules rouges, comme dans les cas d’anémie. De plus, la plongée en apnée que l’on observe chez des mammifères comme les pinnipèdes, mais aussi des oiseaux et des reptiles, provoque un arrêt d’apport d’oxygène. L’activité physique peut augmenter les besoins en oxygène d’une cellule (par exemple, une cellule musculaire) au-delà de l’apport en oxygène courant. Si on combine exercice physique et altitude, ou exercice physique et plongée en apnée, on obtient tout un cocktail de stress pour la cellule. Finalement, certains organismes, dont plusieurs vertébrés, vivent des phases durant lesquelles ils ont un rythme respiratoire très bas comparativement aux mêmes individus dans la phase active, par exemple durant la torpeur, l’estivation ou l’hibernation, ce qui diminue l’apport en oxygène [15, 16].
3.Le fonctionnement du système respiratoire
Afin de comprendre comment le système respiratoire répond à l’hypoxie aigüe, c’est-à-dire dans ce cas-ci un changement soudain et de courte durée, nous devons d’abord connaitre le rôle de la respiration, ainsi que la façon par laquelle son rythme est généré et modulé par le centre respiratoire.
3.1 Le rôle de la respiration
La sous-section 3.1 est adaptée de [17].
On suppose souvent que le rôle le plus immédiat du système respiratoire est de maintenir les niveaux d’oxygène artériel, mais ce n’est pas toujours le cas. Chez les animaux aquatiques, c’est sa fonction première, mais chez les animaux terrestres comme les humains, le rôle homéostatique principal du poumon est de maintenir une pression partielle de CO2 artérielle constante. Le contrôle de la respiration chez les humains est beaucoup plus orienté vers cela que le maintien de l’oxygène artériel, sauf dans des cas particuliers comme en altitude.
Le contrôle du CO2 artériel est critique parce qu’il affecte l’équilibre acidobasique en influençant le pH artériel. Trop de CO2 dans le sang et dans les tissus entraine une acidose, tandis que trop peu augmente le pH et produit une alcalose. Chez les humains, tout écart par rapport à un pH défini d’environ 7,4 peut être très dangereux, car les changements de pH génèrent rapidement des changements dans la forme et la fonction des protéines, ce qui affecte leur fonction.
Le reste de la section 3 est adapté de [18].
3.2 L’arc réflexe du rythme respiratoire
La respiration a un rythme qui est produit par un générateur de rythme. Ce générateur de rythme est formé par un groupe de neurones situés dans un des trois groupes respiratoires qui constituent les circuits nerveux régulant la respiration. Ce contrôle automatique du rythme respiratoire assure la respiration tout au long de la nuit pendant que nous dormons. Ce rythme respiratoire peut être 1) modulé par l’information de différents mécanorécepteurs dans les poumons, les voies respiratoires et les muscles squelettiques, 2) supplanté par l’émotion ou d’autres fonctions cérébrales supérieures (et les états d’éveil/sommeil) ou 3) modulé par des chémoréflexes pour maintenir l’homéostasie des gaz sanguins (O2/CO2).
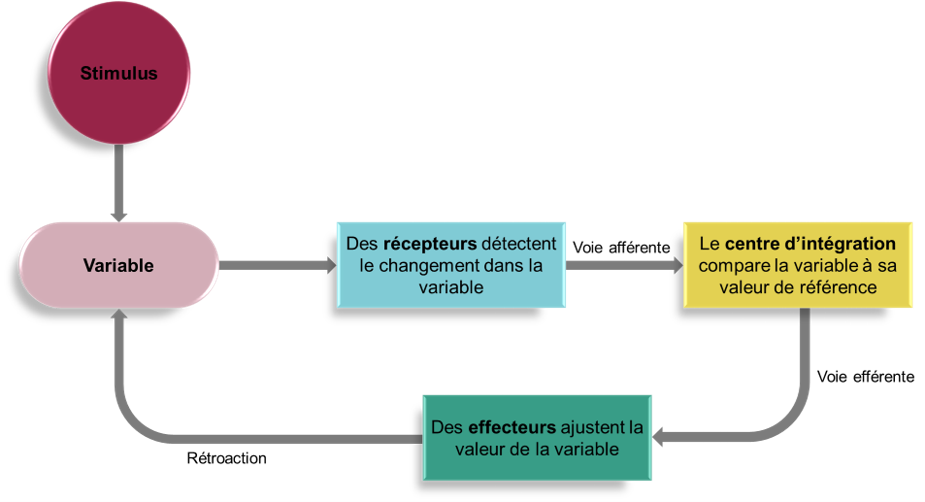
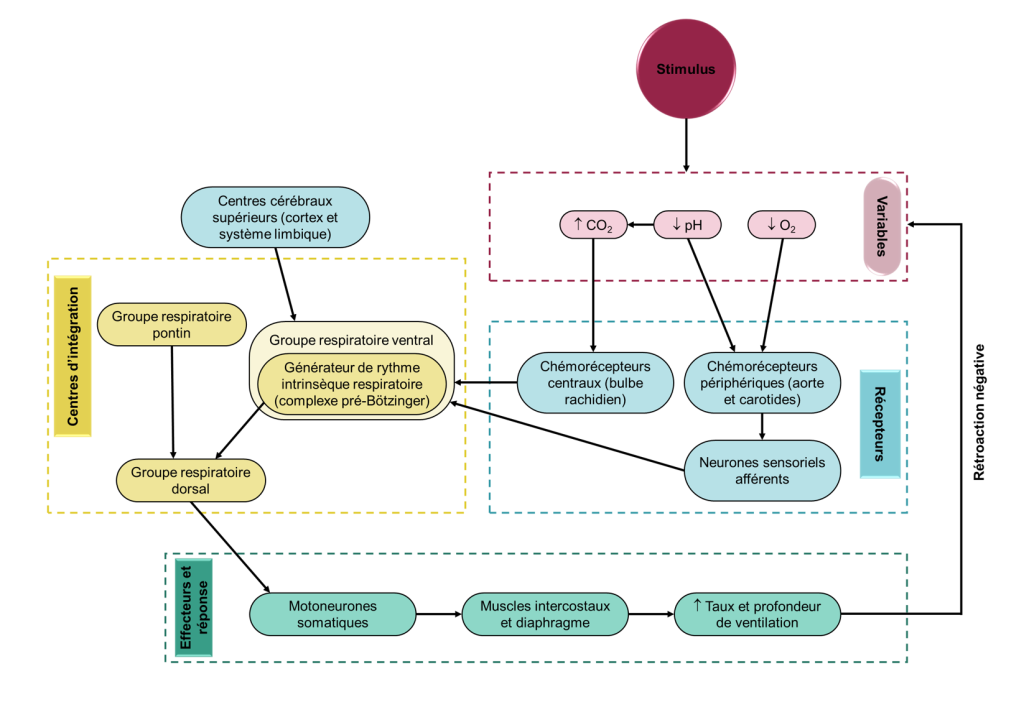
Le réflexe respiratoire est donc un arc réflexe typique, avec des récepteurs sensoriels dans le système vasculaire et les poumons faisant rapport à un centre d’intégration médullaire (le noyau du faisceau solitaire), qui redistribue ces signaux afin de mettre en œuvre des réponses appropriées via des effecteurs, ici les muscles respiratoires (figure 19.5). Ce qui diffère de la plupart des réflexes simples, c’est que le centre d’intégration est plutôt complexe et peut être considéré comme un pivot central qui intègre des entrées provenant de plusieurs sources.
L’évolution des circuits respiratoires chez les vertébrés est un sujet passionnant qui demanderait un chapitre à lui seul (voir [20] pour une revue récente). Nous allons nous concentrer sur les régions du système nerveux qui contrôlent la respiration et comment elles interagissent chez l’humain.
Exercices
La rétroaction
3.3 Les circuits respiratoires
On sait depuis longtemps que le tronc cérébral contient des régions critiques pour la production et le contrôle de la respiration, soit le bulbe rachidien (ou medulla oblongata) et le pont, qu’on appelle ensemble les « circuits respiratoires ». Ces régions génèrent le rythme respiratoire ainsi qu’une commande motrice coordonnée; celle-ci sera ajustée de façon réflexive afin de répondre aux besoins métaboliques de l’organisme (figure 19.6).
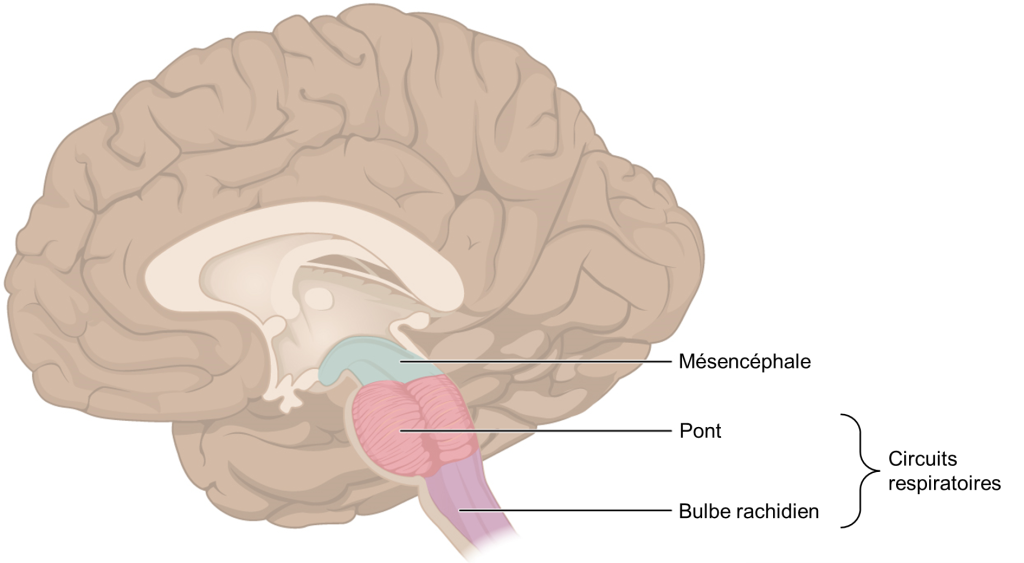
Nous diviserons les circuits respiratoires en trois groupes respiratoires : dorsal, ventral et pontin (figure 19.7). Cette division très simplifiée comparativement à la réalité nous permettra d’avoir une vue d’ensemble du fonctionnement du système.
3.3.1 Le groupe respiratoire dorsal
Les neurones du groupe respiratoire dorsal situés dans la région du bulbe rachidien du tronc cérébral (figure 19.7 ci-dessus) se connectent aux neurones moteurs qui mènent aux muscles inspiratoires (diaphragme et muscles intercostaux). Ces neurones du groupe respiratoire dorsal présentent des poussées d’activité qui provoquent la contraction des muscles inspiratoires pour induire l’inspiration, puis s’arrêtent, permettant aux muscles inspiratoires de se détendre et à l’expiration passive de commencer. Cette activité intermittente peut être modulée par l’apport des afférences sensorielles provenant du nerf vague et glossopharyngien et d’autres régions du système nerveux central (groupe respiratoire pontique), et elle n’est pas spontanée ; cette activité est plutôt initiée par un générateur de rythme respiratoire, qui a son origine dans le groupe respiratoire ventral.
3.3.2 Le groupe respiratoire ventral et le générateur de rythme
De l’autre côté du bulbe rachidien se trouve le groupe respiratoire ventral (figure 19.7 ci-dessus), qui contient des circuits qui contribuent à la genèse du rythme respiratoire. Dans ce groupe respiratoire ventral, un groupe de neurones qui constituent le complexe pré-Bötzinger, qui montre une activité apparemment spontanée, est considéré comme le générateur de rythme intrinsèque respiratoire. En effet, des tranches isolées de cette région du bulbe étudiées in vitro produisent un rythme associé à l’activité respiratoire chez un animal entier (quoique plus lent). Ce complexe est nécessaire et suffisant pour créer un rythme respiratoire et est responsable de l’activité des neurones inspiratoires du groupe respiratoire dorsal. Le complexe pré-Bötzinger coordonne aussi l’activité des neurones expiratoires, capables d’activer les muscles expiratoires lorsque l’expiration doit devenir active plutôt que de rester passive, par exemple, lors de la vocalisation. Pendant la respiration calme au repos, ces neurones expiratoires restent donc inactifs. Le groupe respiratoire ventral contient également des neurones ayant une activité liée à l’inspiration et des connexions aux motoneurones inspiratoires activant le diaphragme et les muscles intercostaux.
3.3.3 Le groupe respiratoire pontin
Le groupe respiratoire pontin (pontin = « dans le pont ») est un autre groupe de neurones du tronc cérébral qui influence les circuits rhythmogéniques du bulbe rachidien afin de produire une activité respiratoire coordonnée et efficace. Il contient les noyaux Kölliker Fuse et parabrachial (historiquement connus sous le nom de centre pneumotaxique). De façon plus précise, le noyau Kölliker Fuse détermine la fin de l’inspiration, agissant comme un interrupteur, assurant ainsi l’alternance entre l’inspiration et l’expiration. Cela permet de coordonner la respiration avec d’autres fonctions comme la toux et la parole.
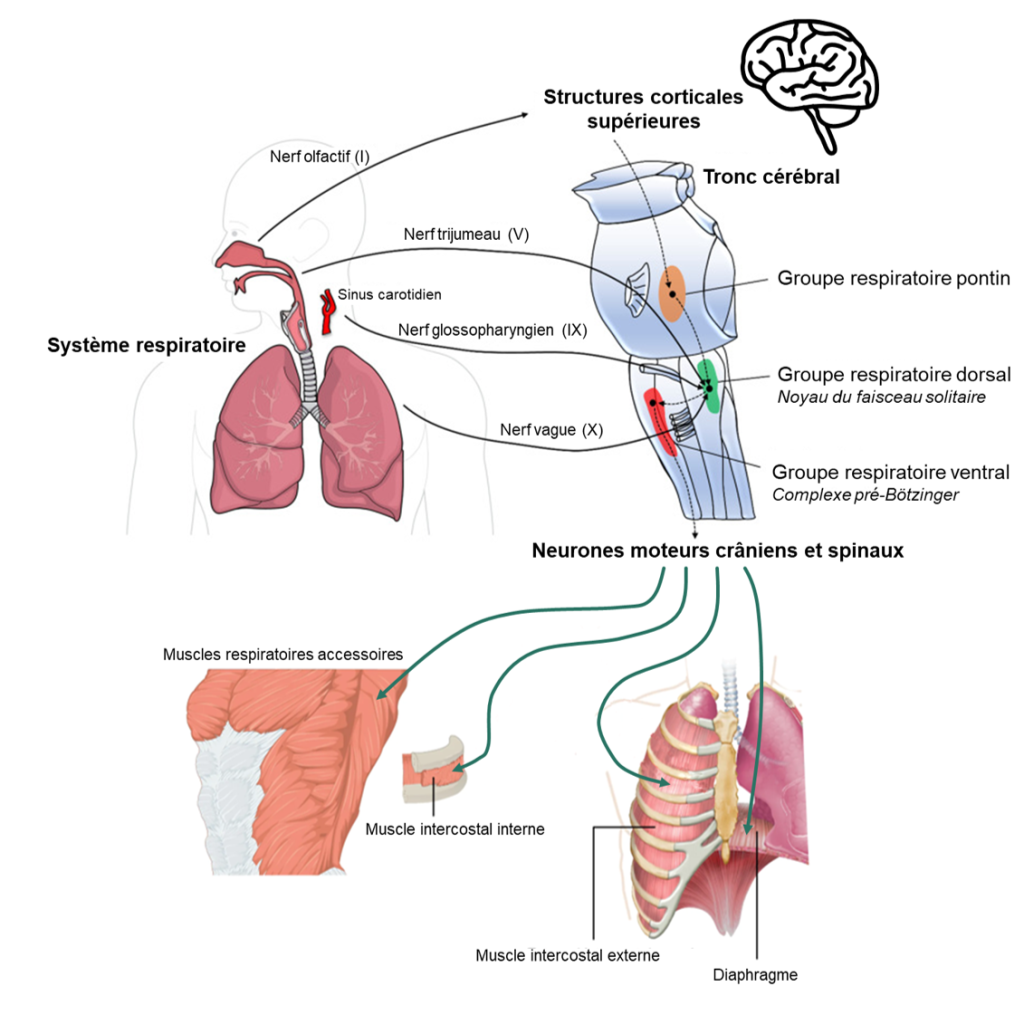
3.4 Apports d’information aux circuits respiratoires
Les circuits respiratoires reçoivent des informations et des directives d’autres influences neurales, incluant de mécanorécepteurs dans les poumons, les voies respiratoires et les muscles squelettiques, des centres cérébraux supérieurs, ainsi que de chémorécepteurs centraux et périphériques (figure 19.7).
3.4.1 Les mécanorécepteurs
Les mécanorécepteurs à l’étirement pulmonaires sont présents dans les parois des voies respiratoires (bronches et bronchioles) et les muscles lisses. Comme leur nom l’indique, ils répondent à l’expansion du poumon et leur activité afférente au tronc cérébral augmente avec le volume pulmonaire. Cette activation mène à un rétrocontrôle négatif qui prévient une expansion excessive des poumons. Ce réflexe, nommé Hering-Breuer, a été découvert chez les mammifères et des mécanismes similaires ont été décrits chez tous les groupes de vertébrés respirant de l’air. Ce mécanisme est orchestré par le centre respiratoire pontique et contribue à terminer la phase inspiratoire, assurant ainsi une respiration efficace et coordonnée.
Les récepteurs d’irritation se trouvent dans l’épithélium des voies respiratoires et sont idéalement placés pour remplir leur rôle de détection des substances nocives entrant dans les poumons, telles que les gaz nocifs, les particules étrangères et même l’air froid. Puisqu’ils visent à protéger les poumons, ils ont généralement une influence inhibitrice sur la volonté de respirer, afin de limiter l’exposition aux substances nocives ou étrangères. D’autres composantes de leur stratégie défensive sont la bronchoconstriction et l’induction du réflexe de toux.
Les récepteurs juxtacapillaires (ou récepteurs J) se trouvent à la jonction des capillaires pulmonaires et des alvéoles. Ces récepteurs répondent aux augmentations de la pression interstitielle et sont donc susceptibles de jouer un rôle dans la réponse à l’œdème pulmonaire. Leur effet sur la volonté de respirer peut être considéré comme excitateur, car ils provoquent une augmentation du rythme respiratoire visant à éviter la baisse d’oxygénation qui est souvent associée à ces stimuli délétères.
3.4.2 Les centres cérébraux supérieurs
La respiration est un exemple rare d’un système que nous pouvons contrôler volontairement malgré le fait que ce soit une activité automatique qui, contrairement à la locomotion, perdure même lors du sommeil ou de l’anesthésie. Par exemple, nous pouvons volontairement remplacer la respiration réflexe pour parler ou plonger en apnée. En fait, nous contrôlons aussi précisément nos muscles respiratoires que nous contrôlons les muscles de nos mains. Les émotions comme la colère, l’anxiété, la tristesse, le bonheur et l’excitation sexuelle peuvent aussi affecter le rythme respiratoire. Pensons par exemple aux soupirs ou au rire. La liste des influences centrales supérieures ne s’arrête pas là. Les changements de lumière modifient la respiration, un son fort et soudain modifie la respiration, faire un problème mathématique modifie la respiration et ainsi de suite. Et malheureusement pour les cliniciens et les physiologistes, le fait de mesurer la respiration modifie la respiration, car dire à quelqu’un que vous allez mesurer sa respiration le fait généralement hyperventiler. Il est donc probable que les rythmes respiratoires normaux chez l’humain que l’on retrouve dans les manuels de science de la santé soient tous trop élevés.
3.4.3 Les chémorécepteurs
Sans surprise, l’influence majeure sur le réflexe respiratoire provient du besoin homéostatique de faire correspondre la ventilation à la demande métabolique et de maintenir les niveaux d’O2, de CO2 et le pH sanguins dans des plages assez étroites. Les valeurs moyennes chez l’humain de pression partielle d’oxygène (pO2) sont d’environ 90 mm Hg et de pression partielle de CO2 (pCO2) d’environ 40 mm Hg. Chez l’humain, les chémorécepteurs sont capables de détecter les changements d’oxygène, de dioxyde de carbone et de pH, modifiant l’activité du centre respiratoire et entrainant un changement approprié de la ventilation. S’il y a une baisse d’oxygène, le taux de ventilation augmente et s’il y a trop de CO2, le taux de ventilation augmente aussi. Ces composantes agissent ensemble dans un circuit de rétroaction négative (figure 19.8). Avant d’entrer dans les détails des chémorécepteurs, faisons un rapide tour d’horizon des circuits de base des chémoréflexes. Il y a deux ensembles de capteurs dans notre circuit : les chémorécepteurs périphériques, qui se trouvent dans le système vasculaire, et les chémorécepteurs centraux qui se trouvent à la surface du tronc cérébral. Les chémorécepteurs périphériques répondent aux modifications du CO2, de l’O2 et du pH artériels tandis que les chémorécepteurs centraux sont capables de détecter les modifications du CO2 artériel ainsi que dans les tissus.
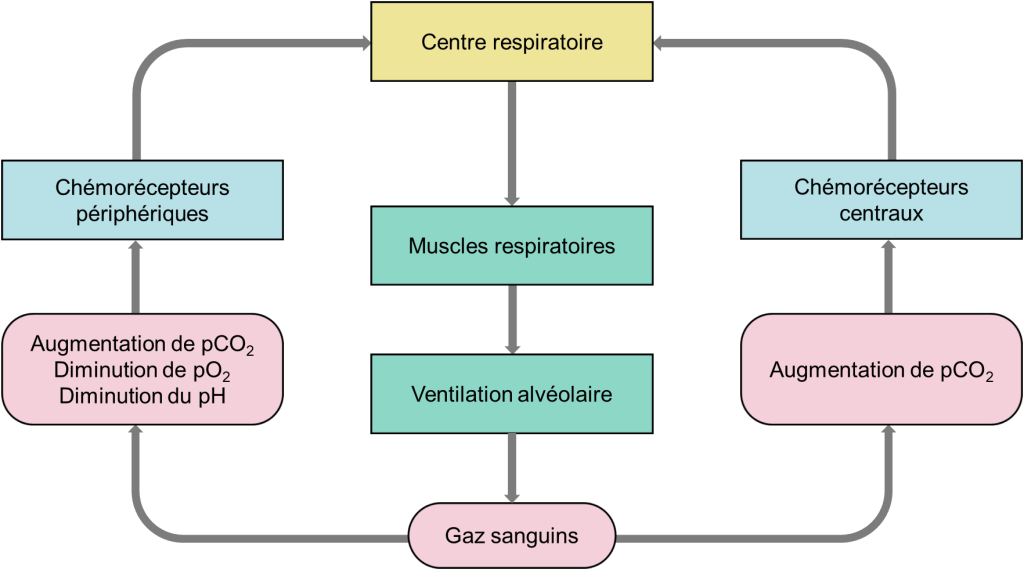
Lors de l’excitation par des changements dans les valeurs des gaz sanguins, ces récepteurs envoient des signaux au centre d’intégration du tronc cérébral. Il en résulte une augmentation de la fréquence du rythme respiratoire et un signal moteur plus important aux muscles respiratoires. Cela produit une augmentation de la ventilation alvéolaire qui corrige les perturbations des concentrations des gaz sanguins. Par une boucle de rétrocontrôle négative, ce retour à l’homéostasie entraine une réduction des signaux des chémorécepteurs (figure 19.8). Avec ce circuit de base à l’esprit, examinons maintenant de plus près les chémorécepteurs et les réponses ventilatoires qu’ils peuvent induire.
3.4.3.1 Les chémorécepteurs centraux
Les chémorécepteurs centraux récoltent de l’information sur les niveaux de CO2 artériel. Cependant, ils ne réagissent pas directement à la pression partielle de CO2 artériel, mais plutôt aux changements de pH du liquide cérébrospinal, en mesurant la concentration de protons H+ dans ce liquide. Ces chémorécepteurs mesurent les ions et non directement le CO2 parce qu’ils ne sont pas exposés au sang, mais sont plutôt derrière la barrière hématoencéphalique et baignés dans le liquide cérébrospinal. Les ions hydrogènes et le bicarbonate ne peuvent pas traverser la barrière hématoencéphalique, contrairement au CO2. Une fois à travers la barrière hématoencéphalique, le CO2 forme de l’acide carbonique. C’est l’ion hydrogène de l’acide carbonique dissocié qui stimule les chémorécepteurs. S’il y a beaucoup de protons, c’est que le pH est bas (acide). Ainsi, les chémorécepteurs centraux répondent à une augmentation du CO2 artériel via une modification du pH du liquide cérébrospinal. Parce qu’il y a peu de protéines dans le liquide cérébrospinal, il y a peu de capacité tampon, et les changements de pH ont tendance à être plus importants que dans le sang, où les protéines plasmatiques sont abondantes. Cela rend les chémorécepteurs centraux assez sensibles et explique en partie leur rôle important dans le contrôle du CO2.
Les principaux chémorécepteurs centraux sont constitués de neurones chémosensibles sur la surface ventrale du bulbe rachidien, dans le noyau rétrotrapézoide. Ces chémorécepteurs centraux ne répondent qu’aux augmentations de CO2 artériel chez l’humain, qu’on appelle hypercapnie (hyper signifie « au-dessus » et capnie signifie « vapeur » en grec) et pas aux variations d’oxygène. Ils perçoivent une augmentation de la pression partielle de CO2 et envoient un message aux groupes respiratoires ventral, dorsal et pontin, ce qui résulte principalement en une augmentation de l’amplitude respiratoire (volume courant) et de la fréquence. Leur activité représente environ 80 % de la réponse ventilatoire à une augmentation de la pression partielle de CO2. Compte tenu de l’importance critique du maintien d’une pression partielle de CO2 normale, ces chémorécepteurs sont considérés comme les plus importants pour la régulation minute par minute de la ventilation chez l’humain.
Ces chémorécepteurs centraux ne répondent pas à l’hypoxie. On peut se demander pourquoi ces chémorécepteurs ne sont pas sensibles à l’oxygène chez les humains. On peut supposer que c’est lié au fait que, pour un mammifère terrestre, il y a habituellement de l’oxygène en bonne quantité. La variable critique est plutôt la quantité de CO2 en circulation. Cependant, cela varie entre les environnements. Par exemple, chez les poissons, le niveau d’oxygène disponible dans l’environnement, perçu par des chémocepteurs périphériques situés dans les tissus épithéliaux des branchies, détermine principalement le taux de ventilation, même si le CO2 joue aussi un rôle [26, 27]. Fait intéressant, les branchies des ancêtres des vertébrés aquatiques avaient pour fonction la régulation ionique et la fonction d’échange gazeux est apparue ultérieurement durant l’évolution [28]. Ainsi, l’étude comparative des chémorécepteurs de différents groupes d’organismes et des systèmes respiratoires en général révèle des différences et des similarités intéressantes d’un point de vue évolutif.
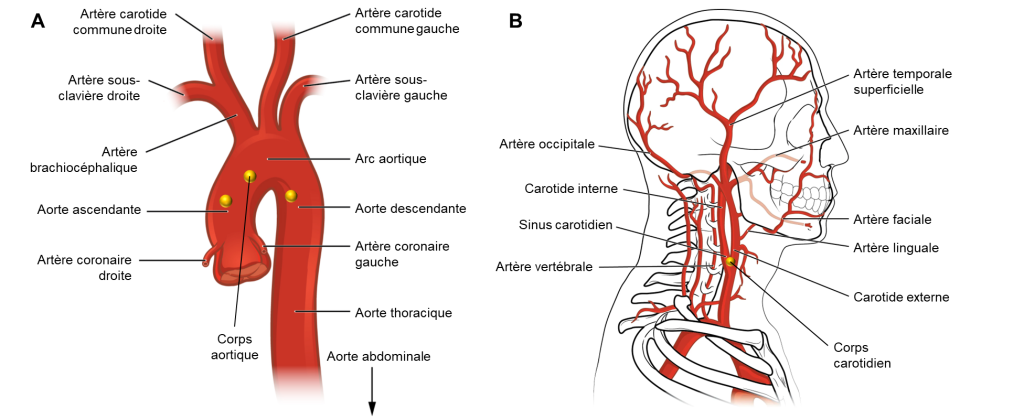
3.4.3.2 Les chémorécepteurs périphériques
Chez les humains, les chémorécepteurs périphériques sont directement exposés au sang artériel et sont capables de répondre aux changements de CO2, O2 et de pH. Il existe deux populations de cellules chémoréceptrices dans le système vasculaire. Une population se trouve dans l’arc aortique et est appelée les corps aortiques (figure 19.9A). L’autre type de chémorécepteur, appelé corps carotidiens, se trouve dans la bifurcation des artères carotides communes (figure 19.9B). Ceux-ci se connectent au tronc cérébral par le sinus carotidien et le nerf vague. Les corps carotidiens sont de loin les plus importants chez l’humain, les corps aortiques contribuant très peu à la réponse ventilatoire.
Les chémorécepteurs périphériques sont entièrement responsables de la réponse respiratoire à une baisse d’oxygène. La principale hypothèse expliquant le mécanisme de fonctionnement de ces récepteurs propose que les cellules chémosensibles des corps carotidiens contiennent des mitochondries qui sont particulièrement sensibles aux baisses d’O2. L’hypoxie inhibe leur fonction, ce qui entraine une série de réactions et de signaux intracellulaires qui dépolarisent la cellule, causant ainsi le relâchement de neurotransmetteurs et la production de potentiels d’action qui seront transmis par le nerf du sinus carotidien vers le noyau du faisceau solitaire dans le groupe respiratoire dorsal. Notons que les corps carotidiens sont des capteurs « multimodaux » qui peuvent aussi détecter les changements de glycémie et répondre à certaines hormones (ex.: leptine) et cytokines.
La réponse des chémorécepteurs périphériques à une baisse de l’oxygène sanguin est loin d’être linéaire. Une baisse de pression partielle d’O2 en dessous de 100 mmHg entraine peu de changement dans le déclenchement de potentiels d’action, mais le taux de déclenchement augmente rapidement à des pO2 inférieures à 50 mmHg. Cela se reflète dans la réponse ventilatoire hypoxique illustrée dans le graphique de la figure 19.10 (attention, il faut lire l’axe des X de droite à gauche). Il y a peu d’augmentation de la ventilation jusqu’à ce que la pO2 alvéolaire soit inférieure à 50 mmHg, puis la ventilation augmente très rapidement. La réponse ventilatoire hypoxique joue normalement peu de rôle dans le contrôle de la respiration chez l’humain, puisqu’il est rare qu’une pO2 si faible soit atteinte. La réponse ventilatoire hypoxique devient importante en altitude lorsque la pression partielle d’oxygène inspirée est faible et atteint ces niveaux critiques sous les 50 mmHg, en cas de maladie pulmonaire, où la ventilation alvéolaire ou les échanges gazeux sont compromis, ou en cas de pathologie comme l’apnée du sommeil.
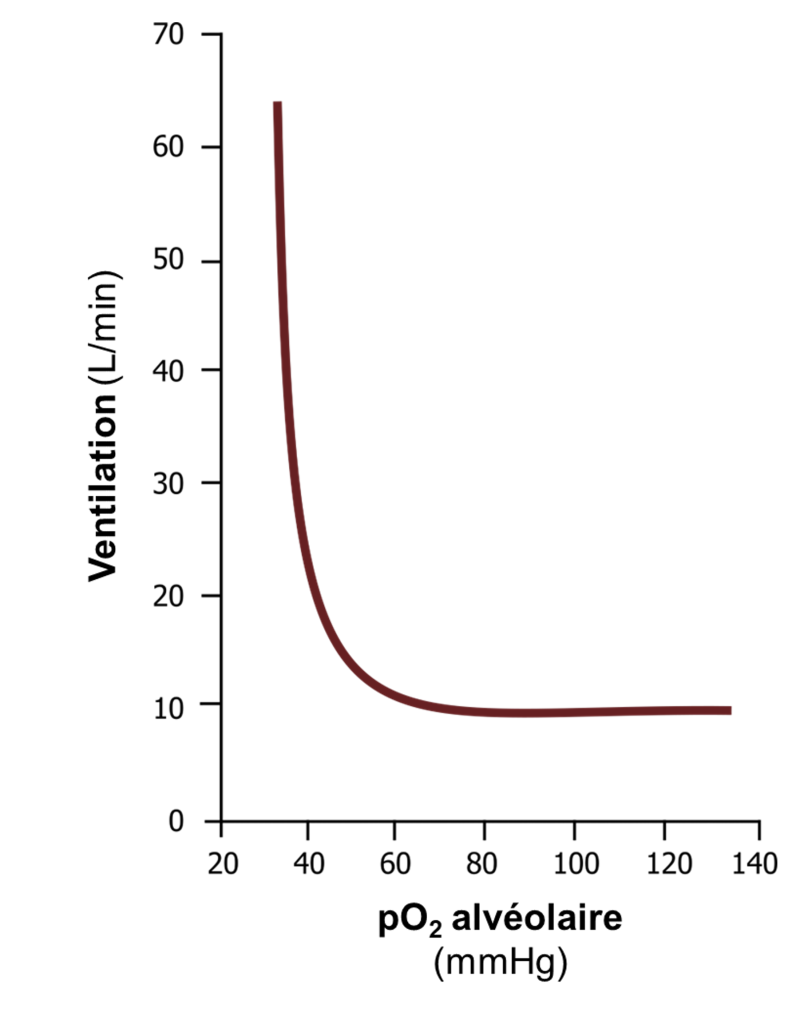
La réponse ventilatoire hypercapnique a beaucoup plus d’influence sur la respiration chez l’humain au quotidien que celle à l’hypoxie. La réponse est très linéaire, avec une augmentation de la pCO2 produisant une augmentation proportionnelle de la ventilation, entrainée bien sûr principalement par les chémorécepteurs centraux, mais également influencée par l’activité afférente des récepteurs périphériques.
En résumé, les circuits respiratoires du tronc cérébral sont composés d’un générateur de rythme intrinsèque de la respiration ainsi que deux autres groupes respiratoires qui ensemble contrôlent différents muscles effecteurs. Le groupe respiratoire dorsal est la principale structure qui reçoit de l’information provenant de récepteurs qui sont stimulés par le CO2, l’O2 et/ou le pH (figure 19.11).
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien: Transcription_chapitre19
4. La réponse du système respiratoire à l’hypoxie aigüe
Maintenant que nous connaissons le fonctionnement du contrôle de la respiration, nous pouvons décrire la réponse du système respiratoire face à l’hypoxie à court terme chez l’humain. Comme illustré dans la figure résumant le contrôle de la respiration (figure 19.11), la perception d’une diminution de la pression partielle d’oxygène artérielle par les chémorécepteurs périphériques entraine une augmentation de la fréquence de la ventilation. Malheureusement, cette réponse qui tente de rétablir l’apport d’oxygène en augmentant la ventilation des poumons a un effet secondaire dangereux sur l’homéostasie sanguine !
4.1 La balance entre le pH, le bicarbonate et le CO2
La section 4.1 est adaptée de [17, 33].
Les cellules produisent du CO2 par leurs voies métaboliques anaérobies et aérobies. Ce CO2 se combine rapidement avec l’eau dans le cytoplasme ou le plasma pour produire de l’acide carbonique. L’acide carbonique est un acide faible, ce qui signifie qu’une partie, mais pas la totalité, se dissocie en un ion hydrogène et un ion bicarbonate. Ces deux molécules sont des acteurs essentiels dans le maintien du pH. Cette équation explique pourquoi le CO2 influence le pH artériel.
CO2 + H2O ⇔ H2CO3 ⇔ H++ HCO3–
Il est essentiel de comprendre que cette équation est réversible et qu’elle décrit un équilibre. Si le CO2 au niveau des tissus augmente, la réaction est entrainée vers la droite et, par conséquent, la quantité d’ions hydrogène augmente et le pH diminue. Inversement, si le CO2 diminue, la réaction est entrainée vers la gauche, de sorte que la concentration en ions hydrogène diminue et que le pH augmente. Le fait que les poumons ont la capacité de contrôler le taux d’expulsion du CO2 du sang explique que les poumons ont également la capacité d’influencer le pH.
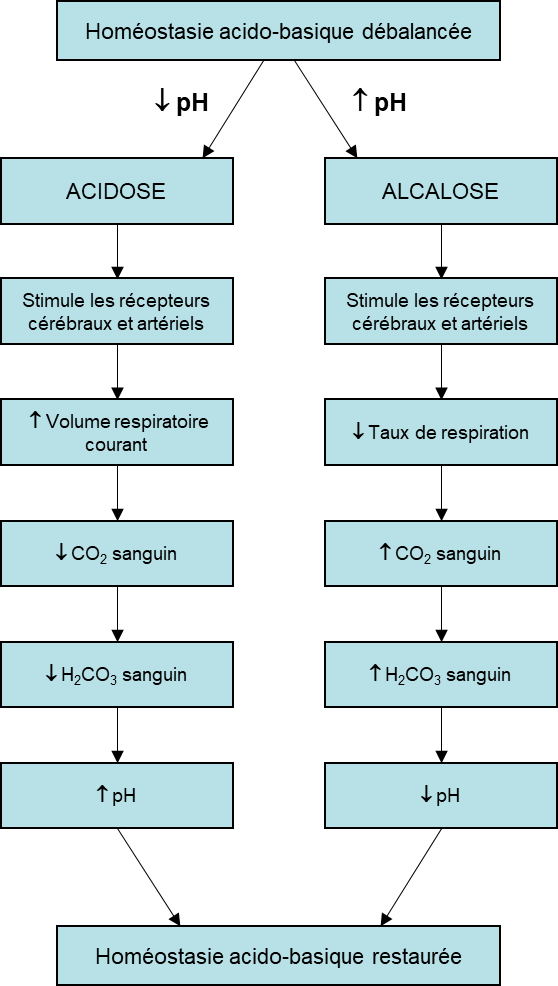
La régulation du pH par la respiration est essentielle, car tout écart par rapport à un pH de référence d’environ 7,4 peut être très dangereux. En effet, les changements de pH génèrent rapidement des changements dans la forme et la fonction des protéines. Au fur et à mesure que les enzymes, les transporteurs membranaires, les canaux et autres commencent à perdre leur fonction, la fonction cellulaire et systémique se détériore rapidement. Avec son taux métabolique élevé et le besoin critique de maintenir le contrôle de son potentiel membranaire, le système nerveux est généralement le premier à souffrir lorsque le pH change. Si on monte au-dessus de 7,7 ou si on descend en dessous de 6,8, cela peut être fatal.
Une respiration rapide (tel que mentionné plus haut lorsque les chémorécepteurs détectent une baisse d’oxygène) débarrasse le sang du CO2 et réduit le niveau d’acide carbonique, rendant le sang trop alcalin. Cette brève alcalose peut être corrigée en réinspirant de l’air expiré dans un sac en papier (ce qui nous fait respirer davantage de CO2 et moins d’oxygène). L’inhalation de l’air expiré ramènera rapidement le pH sanguin vers la normale. Comme vous l’avez peut-être deviné, ce processus fonctionne également dans le sens opposé. Lorsque le niveau de CO2 dans le sang augmente (comme c’est le cas lorsque vous retenez votre respiration), l’excès de CO2 réagit avec l’eau pour former de l’acide carbonique supplémentaire, abaissant le pH sanguin. Augmenter le volume courant de la respiration (vous pourriez en ressentir le « besoin » après avoir retenu votre respiration) vous permet d’expirer plus de CO2. La perte de CO2 du corps réduit les niveaux sanguins d’acide carbonique et ajuste ainsi le pH vers le haut, vers des niveaux normaux (figure 19.12).
Exercices
Équilibre acido-basique
Les sous-sections 4.1.1 et 4.1.2 sont adaptées de [35].
4.1.1 Le diagramme de Davenport
On peut représenter la relation entre la pression partielle de CO2, le bicarbonate (HCO3–) et le pH sanguin (figure 19.13). Ce diagramme de Davenport est construit avec des études expérimentales et est spécifique pour chaque espèce étudiée.
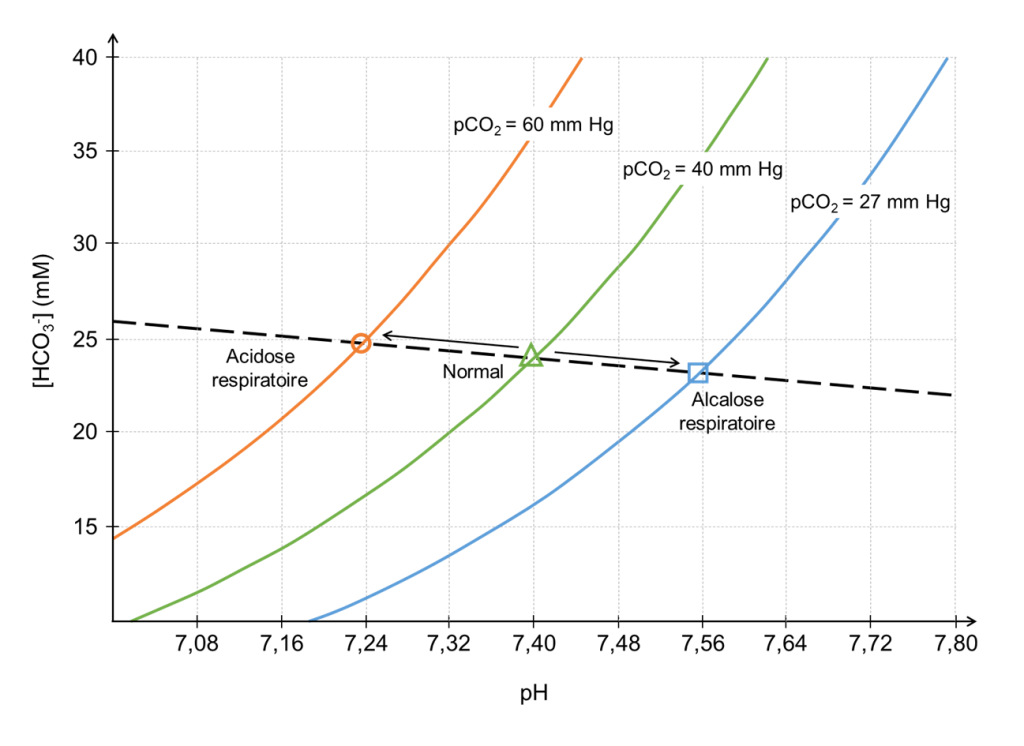
Pour comprendre comment le diagramme doit être interprété, il est utile de comprendre en premier lieu comment le diagramme est produit basé sur des expériences. Prenons l’exemple d’un humain. Un petit échantillon de sang est prélevé sur un patient ou une patiente en bonne santé et placé dans une chambre dans laquelle la pression partielle du dioxyde de carbone (pCO2) est maintenue à 40 mmHg. Une fois l’équilibre atteint, le pH (axe des x) et la concentration en bicarbonate (axe des y) sont mesurés et reportés sur un graphique (le symbole en forme de triangle représente cette donnée au milieu de la figure 19.13).
La deuxième étape de l’expérience est de maintenir la pCO2 dans la chambre tout en modifiant le pH de l’échantillon, d’abord en ajoutant un acide fort, puis en ajoutant une base forte. Le pH est représenté sur l’axe des X et va d’un niveau acide vers un niveau basique. À mesure que le pH varie, une courbe de titrage pour l’échantillon est produite (courbe verte dans la figure 19.13). Notez que cette courbe de titrage n’est valable qu’à une pCO2 de 40 mmHg, car la chambre a été maintenue à cette pression partielle tout au long de l’expérience.
Imaginez ensuite que la personne qui fait l’expérience prélève un nouvel échantillon de sang identique auprès du même individu. Cependant, au lieu de placer l’échantillon dans une chambre avec une pCO2 de 40 mmHg, la chambre est réinitialisée à une pCO2 de 60 mmHg. Après équilibrage, un nouveau point est atteint, indiquant un nouveau pH et une nouvelle concentration en bicarbonate (cercle orange de la figure 19.13). Notez que la concentration en bicarbonate (axe des y) à la nouvelle pCO2 de 60 mmHg est plus élevée que lors de la première mesure, alors que le pH est désormais plus bas (plus à gauche sur l’axe des x). Aucun des deux résultats ne devrait être surprenant si on retourne à l’équation présentée au début de cette section. L’augmentation de la pCO2 créée par la personne qui fait l’expérience signifie que la quantité totale de dioxyde de carbone dans le système a augmenté. Étant donné que le dioxyde de carbone gazeux est en équilibre avec les dérivés du dioxyde de carbone dans la solution, c’est-à-dire le bicarbonate, ces derniers devraient également augmenter. La chute du pH vers un niveau plus acide n’est pas non plus surprenante puisque la formation d’une molécule de bicarbonate est concomitante à la libération d’un proton.
Si cette même expérience est répétée à différentes pressions partielles de dioxyde de carbone, une série de points sera obtenue. On peut tracer une ligne passant par ces points, appelée la ligne tampon (ligne pointillée de la figure 19.13). La ligne tampon peut être utilisée pour prédire le résultat de la variation de la pCO2 dans une plage proche des points déterminés expérimentalement. De plus, pour chaque point expérimental, une expérience de titrage peut être réalisée dans laquelle le pH varie tandis que la pCO2 est maintenue constante, et des courbes de titrage peuvent être générées pour chacune des pressions partielles de dioxyde de carbone (courbes orange, verte et bleue). Dans le diagramme de Davenport, ces courbes de titrage sont appelées isoplèthes, car elles sont générées à une pression partielle fixe de dioxyde de carbone.
4.1.2 L’alcalose respiratoire
Avec ce graphique, vous pouvez prédire ce qui va arriver quand un humain hyperventile. En condition normale pour un humain, la pression partielle de CO2 est d’environ 40 mmHg et le pH sanguin est à 7,4. Si une personne hyperventile, qu’est-ce qui arrive à la pression partielle de CO2 sanguin? Elle diminue (ici on irait jusqu’à 27 mmHg sur le graphique, soit le symbole carré bleu). Cette diminution du CO2 sanguin s’appelle l’hypocapnie. Quel est l’effet sur le pH? Celui-ci augmente, dans le cas présent si on se fie au graphique, autour de 7,56. Le résultat est une alcalose respiratoire, car le pH n’est plus optimal et est trop basique.
Il y a une autre raison pour laquelle il est dangereux d’hyperventiler, en plus des effets sur le pH. Nous avons vu que ce sont les variations de pCO2 qui contrôlent principalement le taux de respiration. Si on hyperventile pendant notre sommeil, comme lorsqu’on est en altitude pendant une expédition en montagne, on a une baisse marquée de la pCO2 sanguine, ce qui résultera en une baisse de la fréquence de la respiration. On est donc en manque d’oxygène dû à l’altitude, ce qui cause une hyperventilation, qui entraine une diminution du CO2 sanguin plus bas que la normale, ce qui indique à notre centre respiratoire de ralentir la respiration. On est donc dans une spirale physiologique dangereuse.
5. La réponse du système circulatoire à l’hypoxie aigüe
Face à une baisse de la pression partielle d’oxygène, on observe aussi une réponse à court terme du système circulatoire. Cette réponse passe par des changements dans les composantes du transport de l’oxygène dans le sang et sur le système cardiovasculaire. Elle est moins rapide que la réponse du système respiratoire.
5.1 Effet sur l’hématocrite et l’hémoglobine
La réponse à court terme inclut l’hémoconcentration, c’est-à-dire une augmentation de la proportion des globules rouges, globules blancs et plaquettes dans le sang causé par une augmentation du débit urinaire. À plus long terme, on observe l’initiation de la cascade du facteur de transcription HIF-1 (acronyme de « Hypoxia Inducible Factor », soit « facteur induit par l’hypoxie », figure 19.14) qui augmente la synthèse d’érythropoïétine (l’EPO) menant à une augmentation des globules rouges (érythropoïèse) et de l’hémoglobine. Habituellement, la production d’un globule rouge prend 5 jours à partir de la cellule souche, mais sous l’influence de l’érythropoïétine, elle-même régulée par le facteur de transcription HIF, cette production peut prendre seulement 2 jours. Ces changements aident à maintenir la livraison de l’oxygène aux cellules, mais augmentent la viscosité du sang, ce qui peut avoir des effets néfastes, tels que la thrombose ou la circulation inefficace dans les capillaires [37].
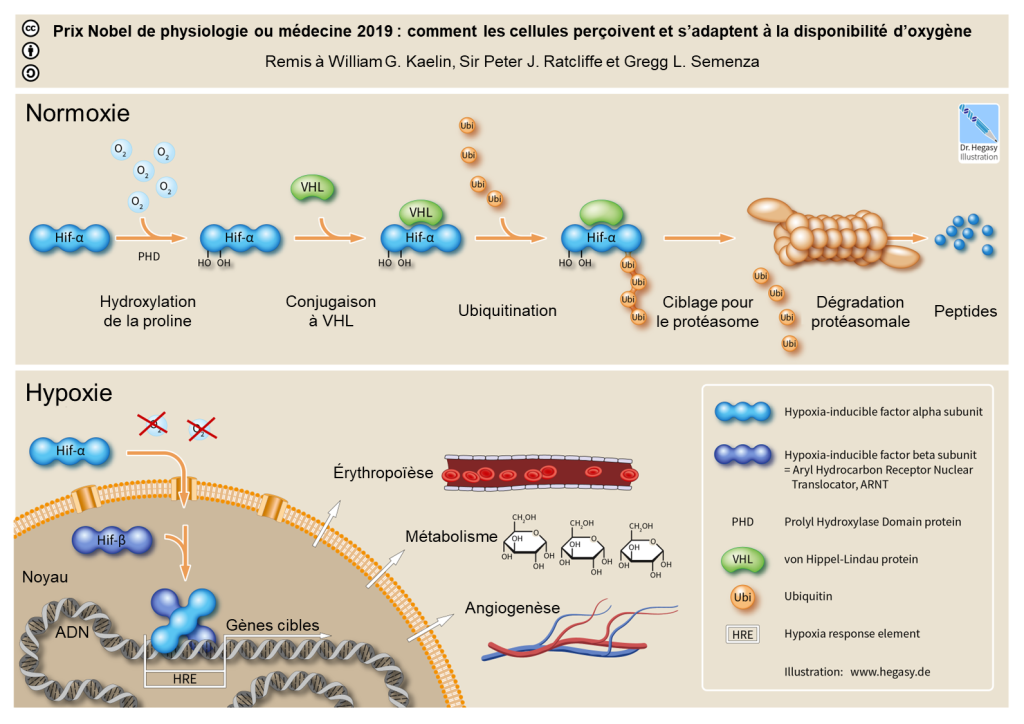
5.2 Effet sur le rythme et le débit cardiaques et la vasoconstriction
On observe aussi une augmentation du rythme cardiaque et du débit cardiaque, soit le volume de sang fourni par le cœur. On note aussi une vasoconstriction des artérioles pulmonaires qui résulte en une augmentation de la pression dans les artérioles, ce qui peut mener à une accumulation de fluides qui s’échappent des capillaires (œdème), ce qui augmente la distance de diffusion de l’O2 et donc diminue l’efficacité des échanges gazeux [37].
6. Réponse à court terme et acclimatation à l’hypoxie
La section 6 est adaptée de [39].
Ces changements physiologiques en réponse à l’hypoxie sont essentiels pour ramener l’homéostasie. Ces changements à court terme dans le système respiratoire et le système circulatoire ont des effets positifs dans des situations de manque d’O2, par exemple en cas d’anémie ou de perte sanguine élevée. Ces réponses à court terme sont donc adaptatives, car elles augmentent le fitness en permettant la survie.
Ces réponses du système respiratoire et circulatoire sont en revanche inefficaces et même dangereuses à court terme face à l’hypoxie causée par l’altitude. Lorsqu’un habitant des plaines atteint pour la première fois une altitude supérieure à 2 500 mètres (par exemple, à Bogotá, la capitale de la Colombie, ou Addis-Abeba, la capitale de l’Éthiopie), son taux d’oxygène dans le sang commence à baisser. Les principaux changements sont une augmentation du rythme respiratoire (hyperventilation) et une élévation de la fréquence cardiaque. Ces taux peuvent atteindre le double de leurs niveaux normaux et persister à des niveaux élevés, même au repos. Bien que ces changements augmentent l’apport d’oxygène à court terme, ils imposent également davantage de stress au corps. Par exemple, l’hyperventilation provoque une alcalose respiratoire, dans laquelle les niveaux de dioxyde de carbone dans le sang deviennent trop bas et le pH augmente. L’augmentation de la fréquence cardiaque exerce un stress sur le système cardiovasculaire et peut être particulièrement dangereuse pour une personne souffrant d’un problème cardiaque sous-jacent.
Ces réponses physiologiques à l’hypoxie entrainent parfois des effets secondaires, des symptômes bien connus des personnes qui font de la recherche sur les effets de l’altitude sur les gens qui y vivent temporairement, comme des travailleurs et des touristes. Il est important de préciser que le mal des montagnes affecte entre 15% et 80% des personnes selon la vitesse d’ascension, le niveau d’altitude, et la susceptibilité individuelle [40]. Les premiers symptômes d’hypoxie que les habitants vivants à basse altitude sont susceptibles de remarquer lorsqu’ils sont en haute altitude sont la fatigue et l’essoufflement lors de l’exécution de tâches physiques. L’appétit est également susceptible de diminuer, car les fonctions corporelles non essentielles sont arrêtées au détriment du maintien d’une respiration et d’un rythme cardiaque rapides. D’autres symptômes sont également susceptibles de se développer, tels que des maux de tête, des étourdissements, une vision déformée, des bourdonnements d’oreilles, des difficultés de concentration, de l’insomnie, des nausées et des vomissements. Ce sont tous des symptômes du mal des montagnes. Des symptômes plus graves peuvent également se développer. Le liquide s’accumule dans les poumons (œdème pulmonaire de haute altitude) et dans de rares cas dans le cerveau (œdème cérébral de haute altitude). La baisse d’oxygène entraine une vasodilatation des capillaires du cerveau, ce qui provoque une fuite capillaire et une perturbation de la barrière hématoencéphalique [41]. L’œdème cérébral peut entrainer des lésions cérébrales permanentes, et les deux types d’œdèmes peuvent être fatals. Plus l’altitude est élevée, plus la probabilité que ces troubles graves de haute altitude surviennent est grande et plus le risque de décès est élevé.
Il est cependant possible de s’acclimater à l’hypoxie en altitude et de voir ces symptômes diminuer, mais pas toujours complètement, même après des semaines. Des changements physiologiques ont lieu à différentes échelles temporelles (figure 19.15). Comme nous avons vu, des globules rouges supplémentaires sont produits et les plus petits vaisseaux sanguins, appelés capillaires, deviennent plus nombreux dans les tissus musculaires. Les poumons augmentent également légèrement en taille, tout comme le ventricule droit du cœur, qui est la cavité cardiaque qui pompe le sang vers les poumons. Tous ces changements rendent plus efficaces les processus d’absorption d’oxygène et de transport vers les cellules.
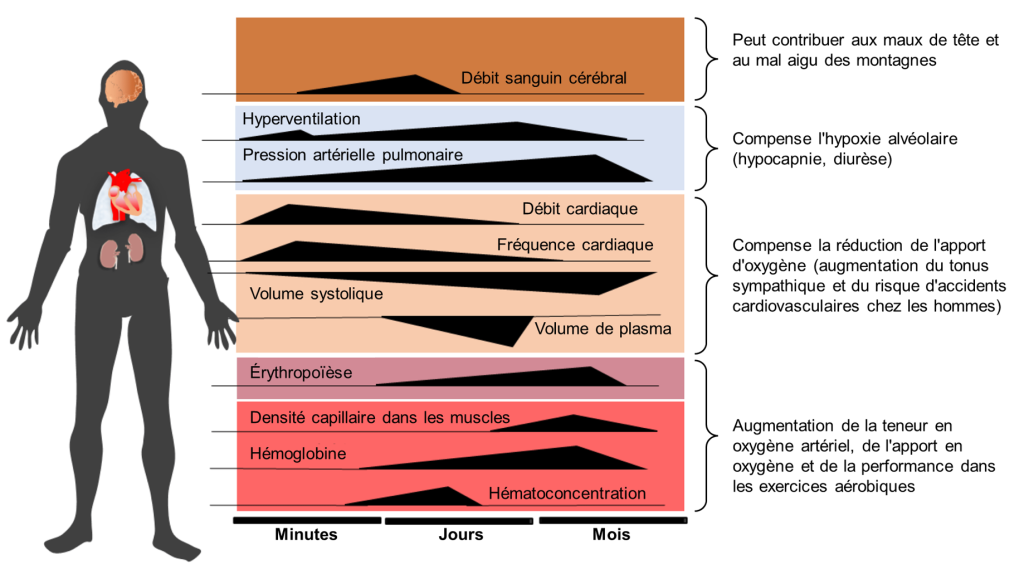
Vous pensez peut-être que ces changements liés à l’acclimatation pourraient améliorer la condition physique et les performances des athlètes, et vous avez raison. Les mêmes changements qui aident le corps à faire face à la haute altitude améliorent la condition physique et les performances à basse altitude. C’est pourquoi les athlètes voyagent souvent à haute altitude pour s’entrainer, puis concourent à basse altitude. Cette pratique favorise la sécrétion d’érythropoïétine (l’EPO) et une hausse de l’hématocrite.
L’acclimatation à la haute altitude prend généralement plusieurs semaines. Plus l’altitude est élevée, plus cela prend du temps. Même lorsque l’acclimatation est réussie et que les symptômes du mal des montagnes diminuent pour la plupart, les habitants des basses terres peuvent ne pas être en mesure d’atteindre le même niveau de performance physique ou mentale qu’il est possible d’atteindre à des altitudes plus basses.
7. Plasticité développementale et hypoxie
La réponse à l’hypoxie peut démontrer de la plasticité phénotypique. La plasticité phénotypique est la capacité d’un génotype de répondre à l’environnement en modifiant son développement. La réponse à l’hypoxie peut être affectée par l’environnement en début de vie. Un individu exposé à l’hypoxie à une période critique de son développement montrera à l’âge adulte plusieurs changements physiologiques et même morphologiques reliés à la réponse au manque d’oxygène. Par exemple, chez les poissons comme le poisson-zèbre, le niveau d’oxygène durant une période spécifique du développement (la période embryonnaire) entraine une modification de la réponse ventilatoire des adultes face à l’hypoxie. Cependant, une exposition à l’hypoxie plus tard durant le développement, comme au stade larvaire, ne résultera pas en plasticité du développement [27]. Des études récentes montrent que la réponse à l’hypoxie est affectée négativement par la température de l’environnement durant le développement, par exemple chez les poissons [42]. Cela suggère que l’augmentation de la température de l’eau due aux changements climatiques diminuerait la capacité de répondre à l’hypoxie. Il est donc important de prendre en compte l’environnement de développement des individus d’une population avant de conclure que les différences observées entre cette population vivant en hypoxie et une population vivant en normoxie (en milieu aquatique ou des basses terres en milieu terrestre) sont dues à de la variation génétique.
Cas appliqué
Entrevue avec Tessa Blanchard
Cette capsule vidéo [CC-BY] présente une entrevue avec Tessa Blanchard, candidate au doctorat en zoologie dans le laboratoire de Trish Schulte à University of British Columbia à Vancouver. Ses travaux portent sur la plasticité phénotypique chez le fondule (aussi appelé choquemort), un poisson très résistant à l’hypoxie. Vous pouvez activer les sous-titres en français ou en anglais.
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien. Transcription Blanchard en format word
Visite virtuelle du laboratoire Schulte
Vous pouvez visiter virtuellement le laboratoire où Tessa Blanchard fait ses expériences de doctorat pour mesurer l’expression de gènes et la méthylation de l’ADN chez ses poissons fondules élevés à différentes températures. C’est une visite « 360 degrés » où vous changez le point de vue dans l’image en naviguant avec votre souris et vous déplacez entre les différentes sections du laboratoire. Vous pouvez activer un commentaire audio pour chaque section du laboratoire en cliquant sur l’icône de haut-parleur en bas à gauche. Vous pouvez en apprendre plus sur les appareils en cliquant sur les titres avec un « + ».
Résumé
Lorsque le niveau d’oxygène est plus bas que la normale, que ce soit dans l’environnement ou dans un tissu, on parle d’hypoxie. La réponse physiologique à l’hypoxie implique le système respiratoire et le système circulatoire. Le système respiratoire a pour rôles de maintenir les niveaux sanguins d’oxygène ainsi que de maintenir l’équilibre acidobasique à travers sa régulation des niveaux de CO2 sanguins . La respiration est directement impliquée dans le maintien du pH sanguin par son effet sur les niveaux de CO2 sanguin qui affectent la quantité de bicarbonate en circulation ainsi que la quantité de protons, qui affectent le pH sanguin. Le réflexe respiratoire est un arc réflexe contrôlé par les circuits respiratoires dans le système nerveux central. La respiration est modulée par les informations amenées par les mécanorécepteurs et les chémorécepteurs, ainsi que par les afférences provenant des centres cérébraux supérieurs (cognition, états d’éveil/sommeil). La boucle de rétrocontrôle formée par les circuits respiratoires avec ses récepteurs sensoriels et ses effecteurs musculaires entre en jeu dans la réponse du système respiratoire face à l’hypoxie. Cette réponse immédiate est accompagnée à un peu plus long terme par celle du système circulatoire. Celle-ci implique des changements dans la quantité d’hémoglobine et de globules rouges en circulation à la suite du déclenchement de la cascade HIF, une augmentation du rythme cardiaque et de son débit, ainsi que la vasoconstriction des artérioles pulmonaires. Il est possible pour certains organismes de s’acclimater à l’hypoxie par des modifications de leurs systèmes physiologiques. L’environnement durant le développement peut aussi affecter la réponse à l’hypoxie à l’âge adulte, un exemple de plasticité développementale.
Activité de révision
Exercices
Révision sur la régulation des systèmes physiologiques face à l’hypoxie
Bibliographie
- Wikipedia contributors (2022). Oxygen saturation, in Wikipedia, The Free Encyclopedia. [CC-BY-SA]. https://en.wikipedia.org/w/index.php?title=Oxygen_saturation&oldid=1092361484.
- Wikipedia contributors (2023). Oxygen, in Wikipedia, The Free Encyclopedia. [CC-BY-SA]. https://en.wikipedia.org/w/index.php?title=Oxygen&oldid=1193947496.
- Wikipedia contributors (2023). Hypoxia (environmental), in Wikipedia, The Free Encyclopedia. [CC-BY-SA]. https://en.wikipedia.org/w/index.php?title=Hypoxia_(environmental)&oldid=1196792963.
- Roman, M.R., S.B. Brandt, E.D. Houde, and J.J. Pierson (2019). Interactive Effects of Hypoxia and Temperature on Coastal Pelagic Zooplankton and Fish [CC-BY]. Frontiers in Marine Science. 6. https://www.frontiersin.org/articles/10.3389/fmars.2019.00139.
- Vaquer-Sunyer, R. and C.M. Duarte (2008). Thresholds of hypoxia for marine biodiversity Proceedings of the National Academy of Sciences. 105(40): p. 15452-15457. https://www.pnas.org/doi/abs/10.1073/pnas.0803833105.
- Benway, H.M., L. Lorenzoni, A.E. White, B. Fiedler, N.M. Levine, D.P. Nicholson, M.D. DeGrandpre, H.M. Sosik, M.J. Church, T.D. O’Brien, M. Leinen, R.A. Weller, D.M. Karl, S.A. Henson, and R.M. Letelier (2019). Ocean Time Series Observations of Changing Marine Ecosystems: An Era of Integration, Synthesis, and Societal Applications [CC-BY]. Frontiers in Marine Science. 6. https://www.frontiersin.org/articles/10.3389/fmars.2019.00393.
- Galbraith, P.S., Conditions océanographiques physiques dans le golfe du Saint-Laurent en 2017. 2018: Pêches et Océans Canada, Région du Québec, Institut Maurice-Lamontagne.
- Nasa Johnson (2019). The Gulf of St. Lawrence [CC-BY-NC-ND]. https://www.flickr.com/photos/nasa2explore/32900527057.
- Richards, J.G. (2011). Physiological, behavioral and biochemical adaptations of intertidal fishes to hypoxia Journal of Experimental Biology. 214(2): p. 191-199. https://doi.org/10.1242/jeb.047951.
- Bickler, P.E. and L.T. Buck (2007). Hypoxia tolerance in reptiles, amphibians, and fishes: life with variable oxygen availability Annu Rev Physiol. 69: p. 145-70.
- Brauner, C.J. and J.G. Richards (2020). Physiological performance in aquaculture: Using physiology to help define optimal conditions for growth and environmental tolerance, in Fish physiology, Elsevier. p. 83-121.
- Wikipedia contributors (2023). Respiratory system, in Wikipedia, The Free Encyclopedia. [CC-BY-SA]. https://en.wikipedia.org/w/index.php?title=Respiratory_system&oldid=1192760653.
- shrimpo1967 (2012). Mount Everest as seen from Drukair [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Mount_Everest_as_seen_from_Drukair2_PLW_edit.jpg.
- Cruithne9 (2016). Altitude and air pressure & Everest [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Altitude_and_air_pressure_%26_Everest.jpg.
- Pamenter, M.E. (2022). Adaptations to a hypoxic lifestyle in naked mole-rats J Exp Biol. 225(4).
- Drew, K.L., M.B. Harris, J.C. LaManna, M.A. Smith, X.W. Zhu, and Y.L. Ma (2004). Hypoxia tolerance in mammalian heterotherms Journal of Experimental Biology. 207(18): p. 3155-3162. https://doi.org/10.1242/jeb.01114.
- Binks, A. (2022). Arterial PCO2 and pH, in Pulmonary Physiology for Pre-Clinical Students [CC-BY-NC-SA]. Virginia Tech. https://pressbooks.lib.vt.edu/pulmonaryphysiology/chapter/arterial-pco2-and-ph/.
- Binks, A. (2022). Control of Breathing, in Pulmonary Physiology for Pre-Clinical Students [CC-BY-NC-SA]. Virginia Tech. https://pressbooks.lib.vt.edu/pulmonaryphysiology/chapter/control-of-breathing/.
- Open Learning Initiative (n.d). Feedback Loops [CC-BY-NC-SA]. https://courses.lumenlearning.com/suny-ap1/chapter/homeostasis-and-feedback-loops/.
- Milsom, W.K., R. Kinkead, M.S. Hedrick, K. Gilmour, S. Perry, L. Gargaglioni, and T. Wang (2022). Evolution of vertebrate respiratory central rhythm generators Respir Physiol Neurobiol. 295: p. 103781.
- Betts, J.G., P. Desaix, E. Johnson, J.E. Johnson, O. Korol, D. Kruse, B. Poe, J.A. Wise, M. Womble, and K.A. Young (2022). The Brain Stem, in Anatomy and Physiology 2e [CC-BY]. https://openstax.org/books/anatomy-and-physiology-2e/pages/13-2-the-central-nervous-system.
- LAFS (2018). Brain [CC-BY]. https://thenounproject.com/icon/brain-1628842/.
- Gentile, F., T. Bocci, S. Coppola, T. Pozzi, L. Modafferi, A. Priori, and D. Chiumello (2022). Putative Role of the Lung–Brain Axis in the Pathogenesis of COVID-19-Associated Respiratory Failure: A Systematic Review [CC-BY]. Biomedicines. 10(3): p. 729. https://www.mdpi.com/2227-9059/10/3/729.
- Betts, J.G., P. Desaix, E. Johnson, J.E. Johnson, O. Korol, D. Kruse, B. Poe, J.A. Wise, M. Womble, and K.A. Young (2022). Respiratory Centers of the Brain [CC-BY]. https://openstax.org/books/anatomy-and-physiology/pages/22-3-the-process-of-breathing#fig-ch23_03_06.
- Grey, K. (2022). Chemoreflex circuit, in Pulmonary Physiology for Pre-Clinical Students [CC-BY-NC-SA]. https://pressbooks.lib.vt.edu/pulmonaryphysiology/chapter/control-of-breathing/.
- Gilmour, K.M. (2001). The CO2/pH ventilatory drive in fish Comp Biochem Physiol A Mol Integr Physiol. 130(2): p. 219-40.
- Perry, S.F., Y.K. Pan, and K.M. Gilmour (2023). Insights into the control and consequences of breathing adjustments in fishes-from larvae to adults [Review]. Frontiers in Physiology. 14. https://www.frontiersin.org/articles/10.3389/fphys.2023.1065573.
- Sackville, M.A., C.B. Cameron, J.A. Gillis, and C.J. Brauner (2022). Ion regulation at gills precedes gas exchange and the origin of vertebrates Nature. 610(7933): p. 699-703.
- Chruścik, A., K. Kauter, L. Windus, and E. Whiteside (2021). The aorta has distinct regions, in Fundamentals of Anatomy and Physiology [CC-BY-SA]. https://usq.pressbooks.pub/anatomy/chapter/6-10-circulatory-pathways/.
- Chruścik, A., K. Kauter, L. Windus, and E. Whiteside (2021). Arteries supplying the head and neck, in Fundamentals of Anatomy and Physiology [CC-BY-SA]. https://usq.pressbooks.pub/anatomy/chapter/6-10-circulatory-pathways/.
- Grey, K. (2022). Hypoxic ventilatory response, in Pulmonary Physiology for Pre-Clinical Students [CC-BY-NC-SA]. https://pressbooks.lib.vt.edu/pulmonaryphysiology/chapter/control-of-breathing/.
- Sved, A. (2019). Block diagram of the control of the respiratory system [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Block_diagram_of_the_control_of_the_respiratory_system.png.
- Hannah, R. and E. Joo (2022). Respiratory Regulation of Acid-Base Balance, in Animal Physiology [CC0]. University of Alaska Anchorage. https://ua.pressbooks.pub/animalphysiology/chapter/respiratory-regulation-of-acid-base-balance/.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Respiratory Regulation of Blood pH, in Anatomy & Physiology [CC-BY-SA]. https://open.oregonstate.education/aandp/chapter/26-4-acid-base-balance/.
- Wikipedia contributors (2023). Davenport diagram, in Wikipedia, The Free Encyclopedia [CC-BY-SA]. https://en.wikipedia.org/w/index.php?title=Davenport_diagram&oldid=1136183413.
- K90 (2009). Davenport Fig 11 [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Davenport_Fig_11.jpg.
- Mallet, R.T., J. Burtscher, V. Pialoux, Q. Pasha, Y. Ahmad, G.P. Millet, and M. Burtscher (2023). Molecular Mechanisms of High-Altitude Acclimatization [CC-BY]. International Journal of Molecular Sciences. 24(2): p. 1698. https://www.mdpi.com/1422-0067/24/2/1698.
- Hegasy, G. (2019). HIF Nobel Prize Physiology Medicine 2019 [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:HIF_Nobel_Prize_Physiology_Medicine_2019_Hegasy_ENG.png.
- Miller, C. (2022). Human Responses to High Altitude, in Human Biology [CC-BY-NC]. https://humanbiology.pressbooks.tru.ca/chapter/8-8-human-responses-to-high-altitude/.
- Mairer, K., M. Wille, and M. Burtscher (2010). The prevalence of and risk factors for acute mountain sickness in the Eastern and Western Alps High Alt Med Biol. 11(4): p. 343-8.
- Jensen, J.D. and A.L. Vincent (2023). High Altitude Cerebral Edema, in StatPearls, StatPearls Publishing. Copyright © 2023, StatPearls Publishing LLC. Treasure Island (FL) ineligible companies. Disclosure: Andrew Vincent declares no relevant financial relationships with ineligible companies.
- Earhart, M.L., T.S. Blanchard, A.A. Harman, and P.M. Schulte (2022). Hypoxia and High Temperature as Interacting Stressors: Will Plasticity Promote Resilience of Fishes in a Changing World? The Biological Bulletin. 243(2): p. 149-170. https://www.journals.uchicago.edu/doi/abs/10.1086/722115.

