18. Évolution de la vision chromatique
Introduction
Dans ce chapitre, nous aborderons l’évolution de la vision chromatique chez les vertébrés, c’est-à-dire la vision en couleurs. Nous verrons d’abord le fonctionnement du système sensoriel visuel chez les humains, qui permet la perception des couleurs, de la rétine jusqu’au rôle du cerveau dans le traitement de l’information visuelle. Nous allons voir les mécanismes cellulaires impliqués dans la vision en couleurs. Nous verrons ensuite que différents groupes de vertébrés perçoivent un nombre différent de longueurs d’ondes, ce qui affecte leur vision chromatique. Ceci nous amènera à disséquer comment des composantes du système de perception des longueurs d’onde ont évoluées entre ces groupes et particulièrement comment l’évolution de la séquence codante de la protéine opsine affecte sa fonction de transformation de l’énergie des longueurs d’onde en signal nerveux. Finalement, nous discuterons du rôle de la duplication de gène dans l’évolution de la vision chromatique chez les humains et les autres grands singes et les agents de sélection possibles qui ont mené à cette évolution.
Objectifs d’apprentissage
À la fin de ce chapitre, vous serez en mesure de :
- Décrire la structure du système visuel des humains
- Décrire la structure de la rétine et ses composantes cellulaires
- Distinguer les types de photorécepteurs et leurs caractéristiques
- Distinguer les types de photopigments et leurs caractéristiques
- Expliquer la cascade cellulaire qui transforme l’énergie lumineuse en signal nerveux
- Expliquer comment l’information visuelle est traitée dans la rétine
- Expliquer comment les caractéristiques de l’information visuelle sont transmises au cerveau
- Décrire le maintien de la topographie dans le cortex visuel
- Expliquer le rôle du cerveau dans la perception des spectres de couleur
- Décrire l’origine évolutive de la vision chromatique chez les vertébrés
- Expliquer l’évolution de la fonction des opsines par l’évolution de la séquence codante
- Expliquer le processus de duplication de gène qui a mené à la trichromatie chez l’humain
- Contraster les agents de sélection possibles agissant sur l’évolution de la vision trichromate chez les grands singes
Notions clés
- Le système visuel chez l’humain
- La structure de la rétine
- Les couches cellulaires de la rétine
- La fovéa
- Les photorécepteurs de la rétine
- Les photopigments opsines et rhodopsine
- La sensibilité à l’intensité lumineuse varie entre les cônes et les bâtonnets
- La cascade cellulaire menant à la transformation d’un signal lumineux en signal nerveux
- La photoisomérisation du rétinal
- Effets de l’activation de la rhodopsine et des opsines sur l’activité des cellules bipolaires
- La voie nerveuse de l’information visuelle
- Encodage de l’information dans la rétine
- Transfert des caractéristiques de l’information visuelle au cerveau
- Les voies visuelles à l’intérieur du cerveau
- Maintien de la topographie des informations visuelles dans le cortex visuel
- Rôle du cerveau dans la perception des couleurs
- Vision tétrachromatique, trichromatique et dichromatique
- Lien entre la structure et la fonction de la protéine opsine
- La duplication comme source de nouvelle fonction d’une opsine chez l’humain
- Les agents de sélection potentiels de la vision trichromatique chez les primates
- L’hypothèse de la frugivorie
- L’hypothèse de la folivorie
- L’hypothèse de la prédation
Les sections 1, 2 et 3 sont adaptées de [1, 2].
1. Le système visuel chez l’humain
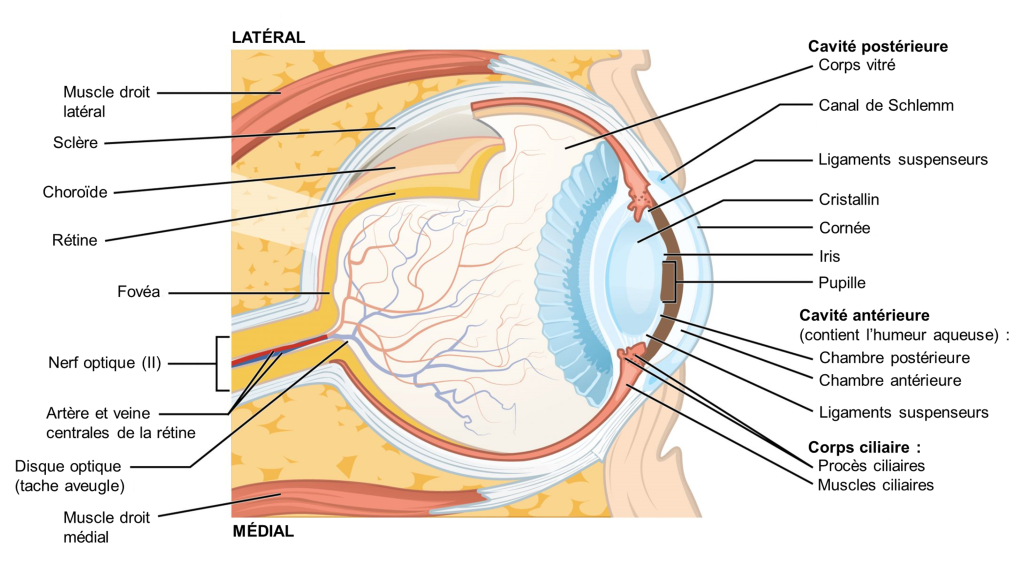
La vision est le sens qui est basé sur la transduction des stimuli lumineux reçus par les yeux. Chez les humains, la lumière qui entre dans l’œil passe à travers la cornée, l’humeur aqueuse, l’ouverture de la pupille délimitée par l’iris, le cristallin, l’humeur vitreuse puis atteint la rétine (figure 18.1).
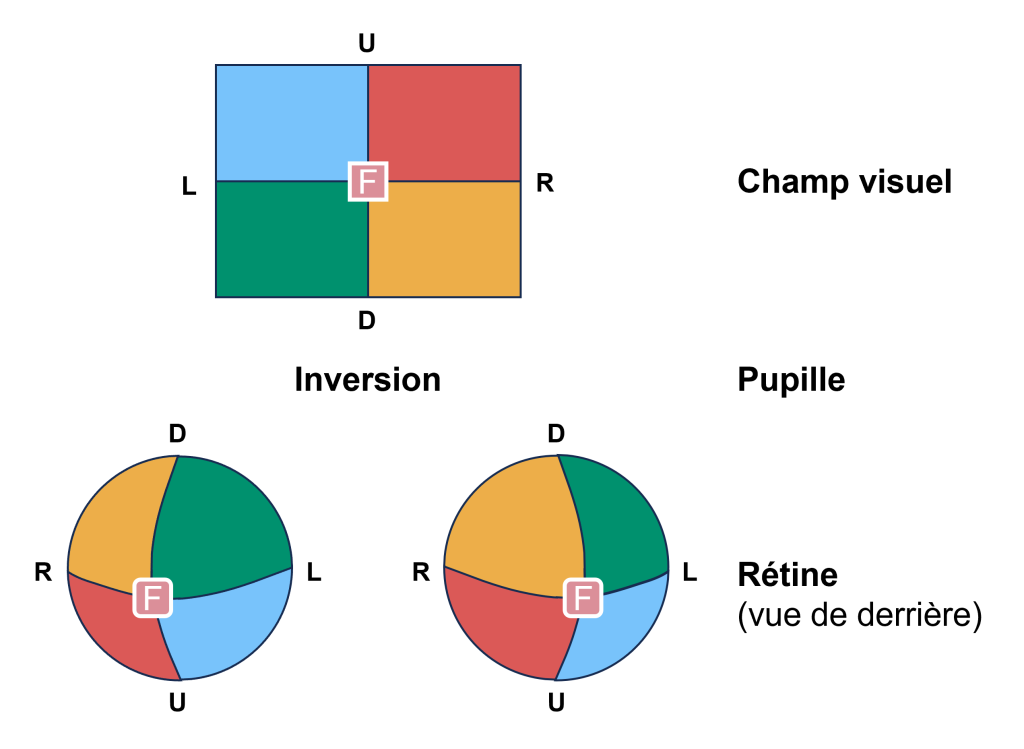
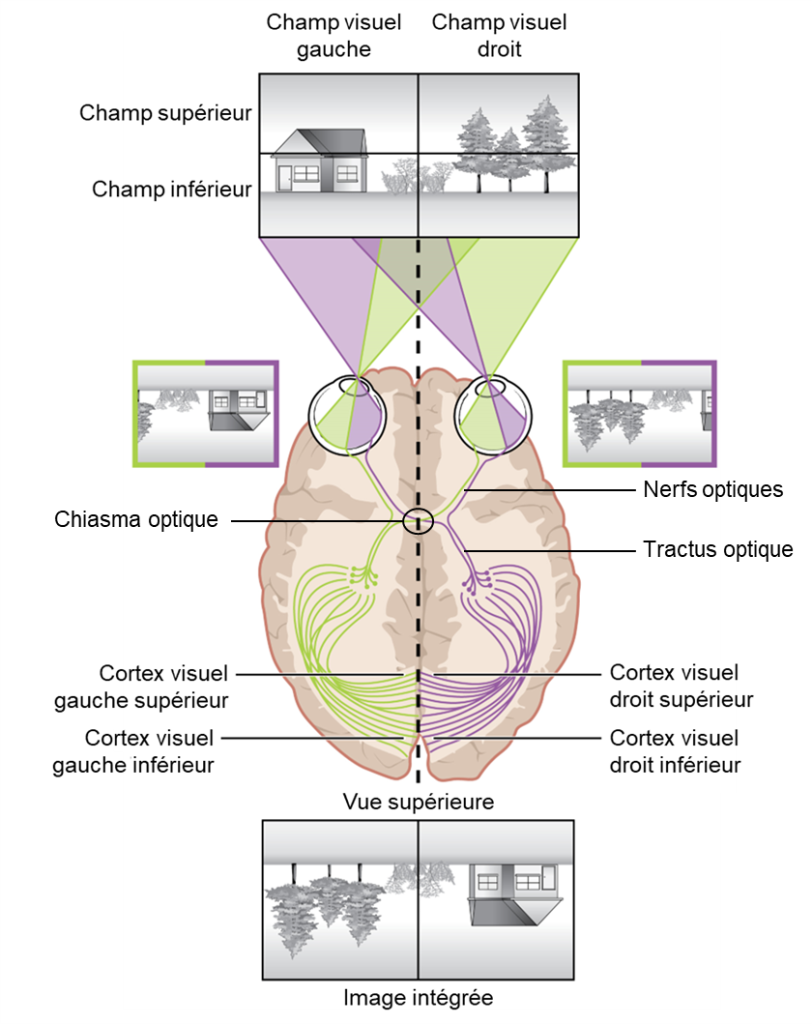
Le champ visuel est projeté sur les deux rétines en miroir renversé (figure 18.2). Ceci veut dire que le champ visuel périphérique droit tombe sur la partie nasale de la rétine droite et la partie temporale de la rétine gauche. De plus, la lumière du champ visuel supérieur tombe sur la rétine inférieure et la lumière du champ visuel inférieur tombe sur la rétine supérieure. Par conséquent, les informations du champ visuel sont inversées et à l’envers sur la rétine : ce qui est en haut à gauche du champ visuel est projeté en bas à droite sur la rétine.
1.1 La structure de la rétine
1.1.1 Les couches cellulaires de la rétine
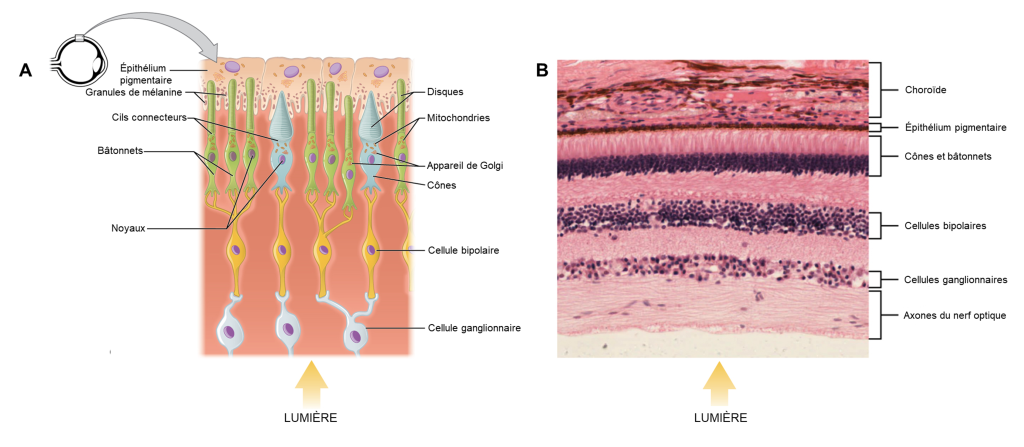
La rétine tapisse le fond de l’œil et est composée de trois couches cellulaires : 1) des photorécepteurs 2) des cellules bipolaires et 3) des cellules ganglionnaires rétiniennes (figure 18.3). Les photorécepteurs sont des cellules spécialisées pour la détection et le traitement initial des stimuli visuels. Les deux types de photorécepteurs, les bâtonnets et les cônes, modifient leur potentiel membranaire lorsqu’ils sont stimulés par l’énergie lumineuse. Le changement de potentiel membranaire modifie la quantité de neurotransmetteur que les cellules photoréceptrices libèrent vers les cellules bipolaires. Ce sont les cellules bipolaires qui relient un photorécepteur à une cellule ganglionnaire rétinienne. Les axones des cellules ganglionnaires rétiniennes se rassemblent au niveau du disque optique et quittent l’œil en formant le nerf optique (voir figure 18.1). Parce que ces axones traversent carrément à un endroit de la rétine, il n’y a pas de photorécepteurs tout au fond de l’œil, là où commence le nerf optique. Cela crée une « tache aveugle » dans la rétine et une tache aveugle correspondante dans notre champ visuel.
1.1.2 La fovéa
Il est important de noter que les photorécepteurs de la rétine sont situés derrière les axones, les cellules ganglionnaires rétiniennes, les cellules bipolaires et les vaisseaux sanguins rétiniens. Une quantité importante de lumière est absorbée par ces structures avant que la lumière n’atteigne les cellules photoréceptrices. Cependant, au centre exact de la rétine se trouve une petite zone connue sous le nom de fovéa. L’acuité visuelle, ou la netteté de la vision, est la plus grande au niveau de la fovéa pour deux raisons : la quantité de lumière qui atteint les photorécepteurs et la connexion avec les cellules ganglionnaires rétiniennes. Premièrement, au niveau de la fovéa, la rétine est dépourvue des cellules de soutien et de vaisseaux sanguins et ne contient que des photorécepteurs. C’est l’endroit où le plus de lumière entrante atteint les photorécepteurs, car elle n’est pas absorbée par les autres structures. C’est le premier facteur qui augmente la netteté de la vision. Ainsi, lorsque l’on se déplace dans l’une ou l’autre direction à partir de ce point central de la rétine, l’acuité visuelle diminue considérablement. Deuxièmement, chaque cellule photoréceptrice de la fovéa est connectée à une seule cellule ganglionnaire rétinienne. Par conséquent, ces cellules ganglionnaires rétiniennes n’ont pas à intégrer les entrées de plusieurs photorécepteurs, ce qui augmente la précision de la transduction visuelle. Vers les bords de la rétine, plusieurs photorécepteurs convergent vers les cellules ganglionnaires rétiniennes (en passant par les cellules bipolaires) jusqu’à un rapport de 50 à 1. Vous pouvez tester vous-même la différence d’acuité visuelle entre la fovéa et la rétine périphérique en regardant directement un mot au milieu de ce paragraphe. Le stimulus visuel au milieu du champ de vision tombe sur la fovéa et est le plus net. Sans quitter ce mot des yeux, remarquez que les mots au début ou à la fin du paragraphe ne sont pas nets. Les images de votre vision périphérique sont focalisées par la rétine périphérique et ont des bords vagues et flous et des mots qui ne sont pas aussi clairement identifiés. En conséquence, une grande partie de la fonction neurale des yeux consiste à déplacer les yeux et la tête afin que les stimuli visuels importants soient centrés sur la fovéa.
Exercices
Parcours de la lumière
1.1.3. Les photorécepteurs de la rétine
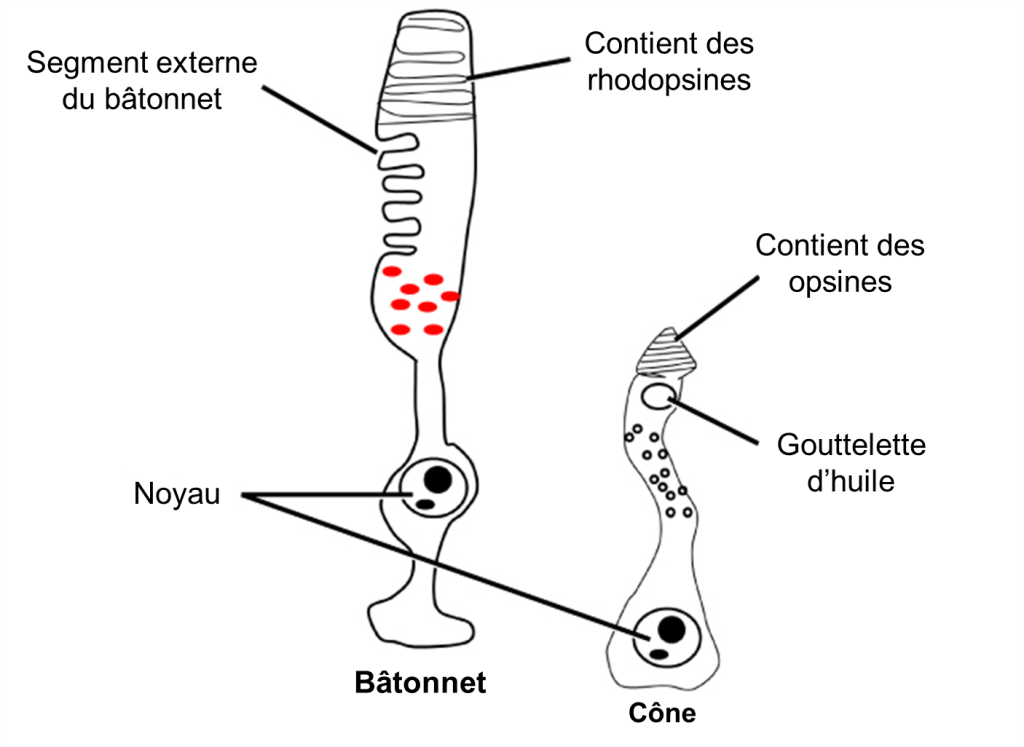
La lumière qui arrive à la rétine provoque des modifications chimiques des molécules de pigment dans les photorécepteurs, entrainant éventuellement une modification de l’activité des cellules ganglionnaires rétiniennes. Les cellules photoréceptrices ont deux parties, le segment interne et le segment externe (Figure 18.4). Le segment interne contient le noyau et d’autres organites communs d’une cellule, tandis que le segment externe est une région spécialisée dans laquelle la photoréception a lieu. Il existe deux types de photorécepteurs, les bâtonnets et les cônes, qui diffèrent par la forme de leur segment externe. Les segments externes en forme de bâtonnet du photorécepteur à bâtonnet (surprise!) contiennent une pile de disques formés de la membrane cellulaire qui se replie. Ces disques contiennent le pigment photosensible appelé rhodopsine. Les segments externes en forme de cône du photorécepteur à cône contiennent aussi leurs pigments photosensibles dans les replis de la membrane cellulaire externe, les opsines.
1.1.4 Les photopigments opsine et rhodopsine
Une seule unité de lumière s’appelle un photon, qui est décrit en physique comme un paquet d’énergie avec les propriétés à la fois d’une particule et d’une onde. L’énergie d’un photon est représentée par sa longueur d’onde, chaque longueur d’onde de lumière visible correspondant à une couleur particulière. La lumière visible est un rayonnement électromagnétique dont la longueur d’onde est comprise entre 380 et 720 nm (figure 18.5). Les longueurs d’onde de rayonnement électromagnétique supérieures à 720 nm tombent dans la plage infrarouge, tandis que les longueurs d’onde inférieures à 380 nm tombent dans la plage ultraviolette. La lumière avec une longueur d’onde de 380 nm est bleue tandis que la lumière avec une longueur d’onde de 720 nm est rouge foncé. Toutes les autres couleurs se situent entre le rouge et le bleu à divers points le long de l’échelle de longueur d’onde.
Chez les humains, les bâtonnets contiennent le photopigment rhodopsine, qui a une sensibilité maximale à une longueur d’onde spécifique de 498 nm (figure 18.5, courbe en pointillé). Les humains ont aussi trois photopigments de cônes, appelés opsines, qui sont chacun sensibles à une longueur d’onde particulière de la lumière (avec une sensibilité qui diminue dans un intervalle autour de cette longueur d’onde), et donc à une couleur (bien qu’un certain intervalle existe autour de cette couleur, figure 18.5). Chez les humains, les trois opsines de couleur ont des sensibilités maximales de 564 nm, 534 nm et 420 nm correspondant approximativement aux couleurs primaires du rouge, du vert et du bleu. La sensibilité maximale est à une longueur d’onde spécifique, mais les longueurs d’onde adjacentes peuvent aussi activer l’opsine avec une sensibilité décroissante à mesure qu’on s’éloigne de la valeur maximale. Les deux types de photorécepteurs fonctionnent de la même façon et c’est leur structure physique (dictée par leur séquence protéique) et le type de photopigment (rhodopsine ou opsine) qui les distingue.
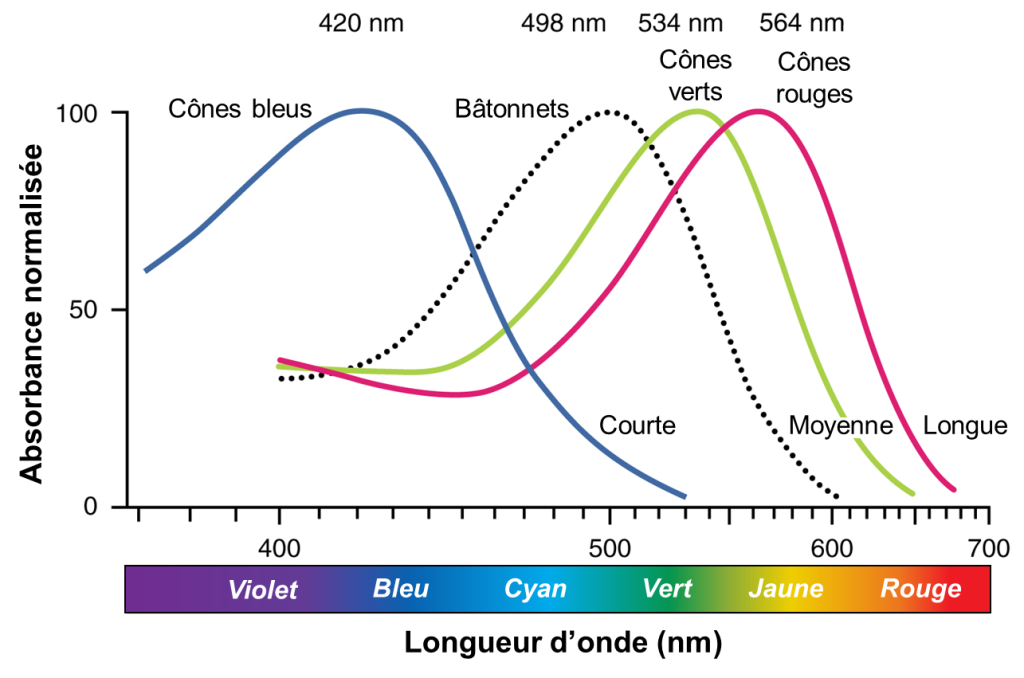
1.1.5 La sensibilité à l’intensité lumineuse varie entre les cônes et les bâtonnets
L’absorbance de la rhodopsine dans les bâtonnets est beaucoup plus sensible que dans les opsines des cônes; plus précisément, les bâtonnets sont sensibles à la vision dans des conditions de faible luminosité et les cônes sont sensibles à des conditions plus lumineuses. En plein soleil normal, la rhodopsine sera constamment blanchie pendant que les cônes sont actifs. Dans un endroit sombre, il n’y a pas assez de lumière pour activer les opsines des cônes et la vision dépend entièrement des bâtonnets. Les bâtonnets sont si sensibles à la lumière qu’un seul photon peut entrainer un potentiel d’action dans la cellule ganglionnaire correspondant à un bâtonnet. Notre vision en basse lumière est, par essence, en niveaux de gris. Pour ce qui est de la vision chromatique, en comparant l’activité des trois cônes différents, le cerveau peut extraire des informations de couleur à partir de stimuli visuels. Par exemple, une lumière bleue de forte intensité qui a une longueur d’onde d’environ 450 nm activerait les cônes « rouges » de manière minimale, les cônes « verts » marginalement et les cônes « bleus » principalement. L’activation relative des trois cônes différents est interprétée par le cerveau, qui perçoit la couleur comme du bleu.
Les cônes et les bâtonnets ne sont pas répartis également dans la rétine. Chez les humains, les cônes sont plus concentrés dans la région de la fovéa alors que les bâtonnets sont plus présents en périphérie de la rétine. La sensibilité à la lumière de faible intensité est donc plus grande dans la périphérie où se trouvent les bâtonnets. Lorsque vous portez votre regard sur un objet pour l’examiner attentivement en pleine lumière, les yeux s’orientent de manière que l’image de l’objet tombe sur la fovéa. Cependant, lorsque vous regardez une étoile dans le ciel nocturne ou un autre objet dans la pénombre, l’objet peut être mieux vu par la vision périphérique, car ce sont les bâtonnets sur les bords de la rétine, plutôt que les cônes au centre, qui fonctionnent mieux en basse lumière.
2. La cascade cellulaire menant à la transformation d’un signal lumineux en signal nerveux
2.1 La photoisomérisation du rétinal
La rhodopsine des bâtonnets et les opsines des cônes sont des protéines transmembranaires qui contiennent un cofacteur appelé rétinal. Le rétinal est une molécule d’aldéhyde polyinsaturé, une forme de vitamine A. Lorsqu’un photon frappe le rétinal, la longue chaine d’hydrocarbure de la molécule est biochimiquement altérée (figure 18.6). Plus précisément, les photons font passer certains des carbones à double liaison de la chaine d’une conformation cis à une conformation trans. Ce processus est appelé photoisomérisation. Avant d’interagir avec un photon, les carbones flexibles à double liaison du rétinal sont en conformation cis. Cette molécule est appelée 11-cis-rétinal. Un photon interagissant avec la molécule fait passer les carbones flexibles à double liaison à la conformation trans, formant le trans-rétinal, qui a une chaine hydrocarbonée droite.
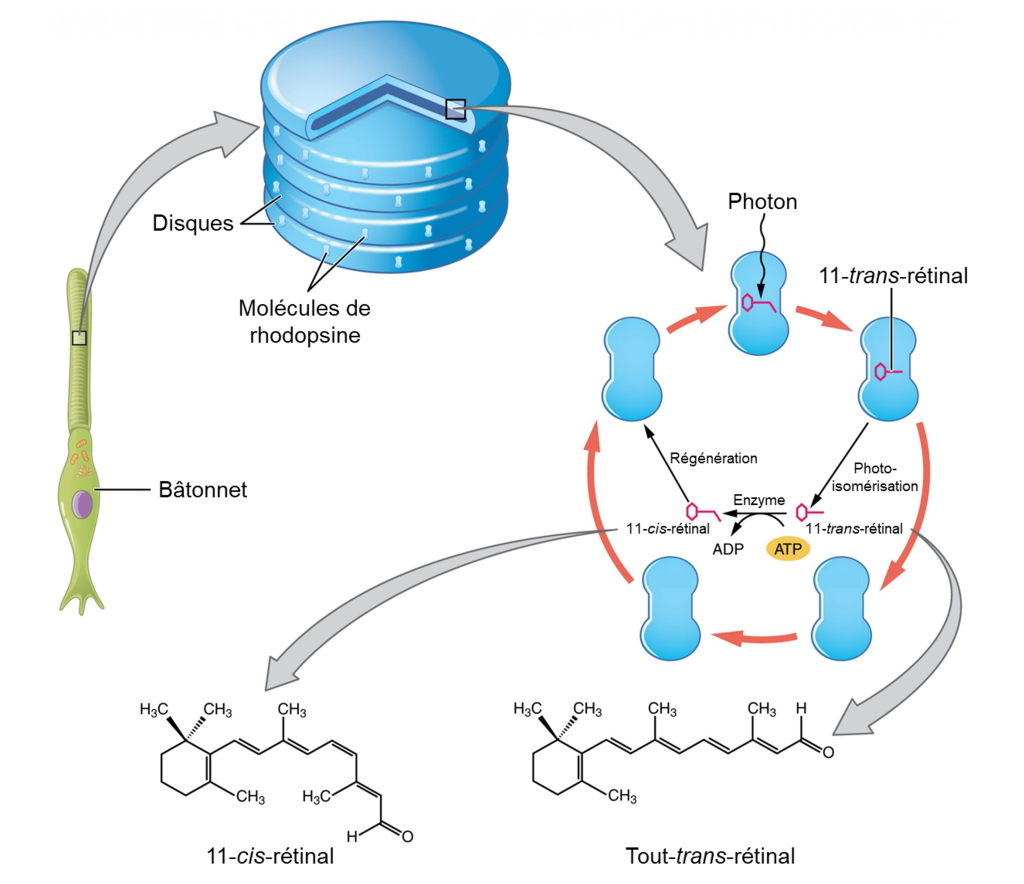
Le changement de forme du rétinal dans les photorécepteurs initie la transduction visuelle dans la rétine. Cette isomérisation du rétinal active l’opsine, déclenchant une cascade d’évènements de signalisation cellulaire. Jusqu’à ce que la molécule rétinal reprenne sa forme 11-cis-rétinal, l’opsine ne peut pas répondre à l’énergie lumineuse, un phénomène appelé blanchiment. La photoisomérisation est inversée par une série de changements enzymatiques de sorte que le rétinal réponde à une nouvelle énergie lumineuse.
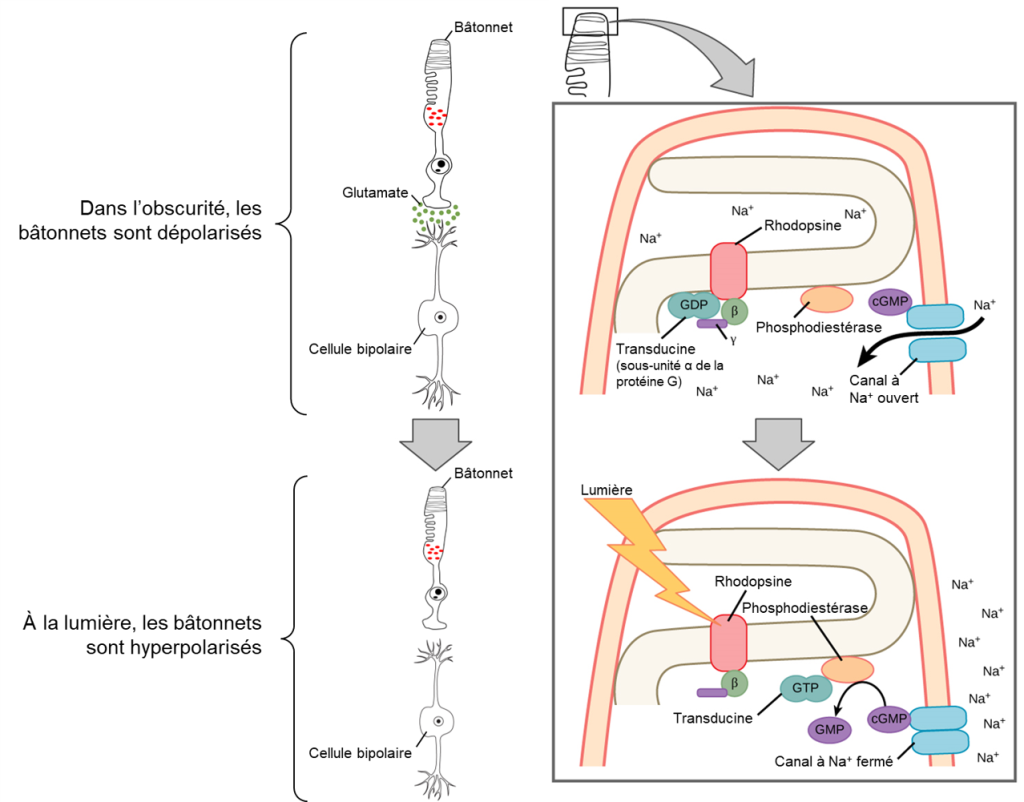
2.2 Effets de l’activation de la rhodopsine et des opsines sur l’activité des cellules bipolaires
Dans l’obscurité, l’opsine et la protéine G associées sont inactives et les canaux à Na+ sont ouverts. Le bâtonnet est donc dépolarisé et libère du glutamate dans sa synapse avec une cellule bipolaire. Lorsque la lumière frappe l’opsine, le rétinal change de conformation, la protéine G appelée transducine est activée et active à son tour la phosphodiestérase. La phosphodiestérase convertit le cGMP en GMP, fermant ainsi les canaux sodiques. En conséquence, la membrane devient hyperpolarisée. La membrane hyperpolarisée libère moins ou pas de glutamate vers la cellule bipolaire (la figure 18.7 illustre le mécanisme pour un bâtonnet). La cellule bipolaire devient elle aussi hyperpolarisée (cellule bipolaire « OFF »), mais il existe aussi des cellules bipolaires qui sont dépolarisées par l’hyperpolarisation du photorécepteur (cellules bipolaires « ON »). En effet, les signaux inverses produits par différentes cellules bipolaires forment un signal qui est interprété comme du contraste. Ce sujet fascinant et complexe ne peut être expliqué en détail ici. Ainsi, contrairement à la plupart des autres neurones sensoriels (qui se dépolarisent par exposition à un stimulus), les récepteurs visuels deviennent hyperpolarisés et donc éloignés du seuil de dépolarisation lorsqu’il y a de la lumière.
Exercices
Cônes et bâtonnets
3. La voie nerveuse de l’information visuelle
3.1 Encodage de l’information dans la rétine
Un grand degré de traitement des informations visuelles se produit dans la rétine elle-même, avant que les informations visuelles ne soient envoyées au cerveau. Les signaux visuels quittent les cônes et les bâtonnets, voyagent vers les cellules bipolaires, puis vers les cellules ganglionnaires. Les photorécepteurs de la rétine subissent en permanence une activité tonique, comme nous avons vu plus haut. Autrement dit, ils sont toujours légèrement actifs même lorsqu’ils ne sont pas stimulés par la lumière. Dans les neurones qui présentent une activité tonique, l’absence de stimuli maintient un taux de déclenchement à un niveau de base; tandis que certains stimuli augmentent la cadence des potentiels gradués par rapport au rythme de base, et d’autres stimuli diminuent la cadence de ceux-ci. En l’absence de lumière, les neurones bipolaires qui relient les bâtonnets et les cônes aux cellules ganglionnaires sont continuellement et activement inhibés par les bâtonnets et les cônes (ou continuellement activés, selon le type de cellule bipolaire). L’exposition de la rétine à la lumière hyperpolarise les bâtonnets et les cônes et supprime leur relâchement de glutamate dans la synapse avec les cellules bipolaires. Les cellules bipolaires sont hyperpolarisées ou dépolarisées selon leur type, un signal qui se rend à la synapse avec les cellules ganglionnaires, qui envoient des potentiels d’action le long de leurs axones (qui quittent l’œil par le nerf optique). Ainsi, le système visuel s’appuie sur le changement de l’activité rétinienne, plutôt que sur l’absence ou la présence d’activité, pour coder les signaux visuels pour le cerveau.
3.2 Transfert des caractéristiques de l’information visuelle au cerveau
Les axones myélinisés des cellules ganglionnaires constituent les nerfs optiques. Dans les nerfs, différents axones transportent différentes caractéristiques du signal visuel. Certains axones constituent la voie magnocellulaire (grande cellule), qui transporte des informations sur la forme, le mouvement, la profondeur et les différences de luminosité. D’autres axones constituent la voie parvocellulaire (petite cellule), qui transporte des informations sur la couleur et les détails fins. La localisation dans l’espace de l’information visuelle est aussi envoyée au cerveau et ceci se fait de façon assez surprenante : certaines informations visuelles sont projetées directement dans le cerveau, tandis que d’autres informations traversent vers le côté opposé du cerveau. En effet, les connexions du nerf optique sont plus compliquées que celles des autres nerfs crâniens. Au lieu que les connexions soient entre chaque œil et le côté correspondant du cerveau, les informations visuelles sont séparées entre les côtés gauche et droit du champ visuel. De plus, certaines des informations d’un côté du champ visuel se projettent vers le côté opposé du cerveau (figure 18.8). Rappelons-nous que le champ visuel est projeté en miroir renversé sur la rétine. Dans chaque œil, les axones faisant saillie du côté temporal de la rétine (près de la tempe, soit l’extérieur du visage) vont vers le même côté du cerveau. Par exemple, les axones de la rétine temporale de l’œil droit se projettent vers le côté droit du cerveau (en mauve sur la figure 18.8). Cependant, les axones faisant saillie du côté nasal de la rétine (le plus proche du nez) croisent vers l’autre côté au niveau du chiasma optique. Par exemple, les axones de la rétine nasale de l’œil gauche dévient vers le côté droit du cerveau au niveau du chiasma optique (en mauve sur la figure 18.8). Par conséquent, le champ de vision gauche de chaque œil est traité par le côté droit du cerveau, tandis que le champ de vision droit de chaque œil est traité par le côté gauche du cerveau (regardez attentivement la figure 18.8 pour vous en convaincre!) Au-delà du chiasma optique, les axones du système visuel sont appelés le tractus optique au lieu du nerf optique.
3.3 Les voies visuelles à l’intérieur du cerveau
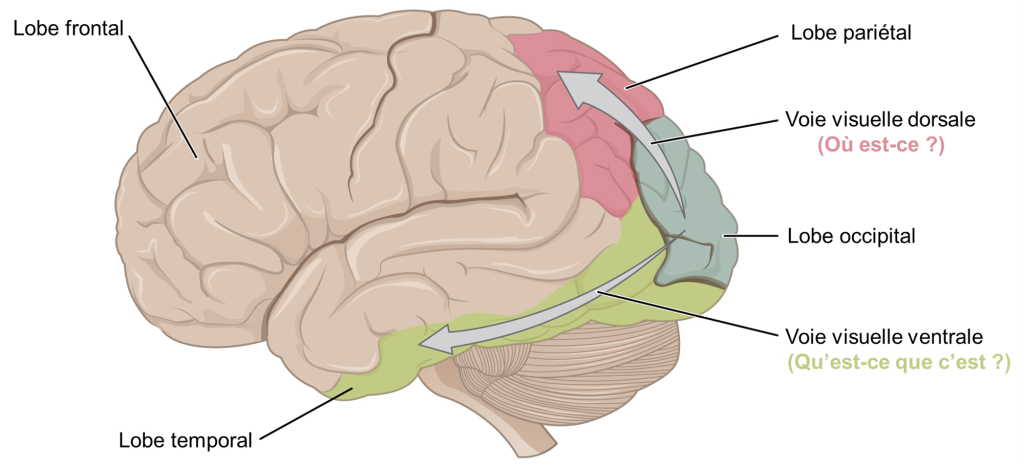
Une fois dans le cerveau, l’information visuelle est traitée à plusieurs endroits, et ses trajets reflètent la complexité et l’importance de l’information visuelle pour les humains et les autres animaux (figure 18.9). Une route achemine les signaux vers le thalamus, qui sert de station d’acheminement pour toutes les impulsions sensorielles entrantes, à l’exception de l’olfaction. Lorsque les signaux visuels quittent le thalamus, ils se dirigent vers le cortex visuel primaire à l’arrière du cerveau dans le lobe occipital. Cette information permettra la perception visuelle consciente. Depuis le cortex visuel, les signaux visuels voyagent dans deux directions. La voie visuelle dorsale est un flux qui se projette vers le lobe pariétal, sur le côté du cerveau, et transporte des informations qui indiquent la localisation dans l’espace de l’information visuelle et son mouvement (où est-ce?). La voie visuelle ventrale est un deuxième flux qui se projette vers le lobe temporal et qui communique de l’information sur l’objet observé : forme, profondeur, différences de luminosité, couleurs, détails fins (qu’est-ce que c’est?). Une autre cible du tractus optique est le colliculus supérieur dans le mésencéphale, où les mouvements oculaires sont coordonnés et intégrés aux informations auditives.
De plus, un très petit nombre d’axones des cellules ganglionnaires rétiniennes se projettent du chiasma optique vers le noyau suprachiasmatique de l’hypothalamus. Ces cellules ganglionnaires sont photosensibles, dans le sens où elles réagissent à la présence ou à l’absence de lumière. Cependant, contrairement aux photorécepteurs, ces cellules ganglionnaires photosensibles ne peuvent pas être utilisées pour percevoir des images. En répondant simplement à l’absence ou à la présence de lumière, ces cellules peuvent envoyer des informations sur la durée du jour. La proportion perçue de lumière solaire et d’obscurité établit le rythme circadien de notre corps, permettant à certains évènements physiologiques de se produire à peu près à la même heure chaque jour.
3.4 Maintien de la topographie des informations visuelles dans le cortex visuel
La topographie de l’image dans le champ visuel est reflétée dans la région du cortex visuel qui traite l’information. Autrement dit, les neurones qui traitent une image sont situés spatialement dans la même forme que cette image, dans la rétine, le thalamus et le cortex visuel. Par conséquent, les parties voisines de la rétine se projettent vers les parties voisines du thalamus et les parties voisines du thalamus se projettent vers les parties voisines du cortex visuel. Ce ne sont donc pas des neurones mélangés partout dans le cortex visuel qui traitent l’information venant de la rétine. Les neurones qui forment la région supérieure du cortex visuel traite le champ visuel inférieur et vice versa. Par conséquent, les informations du champ visuel sont inversées et renversées lorsqu’elles pénètrent dans le cortex visuel — le haut est le bas et la gauche est la droite. Cependant, le cortex traite les informations visuelles de telle sorte que la perception consciente finale du champ visuel est correcte (figure 18.8). Ainsi, les informations provenant de la région fovéale de la rétine sont traitées au centre du cortex visuel primaire. Les informations provenant des régions périphériques de la rétine sont traitées en conséquence vers les bords externes du cortex visuel. Il est intéressant de noter que la zone de traitement fovéale du cortex visuel est disproportionnellement plus grande que les zones de traitement de la vision périphérique. Il y a donc plus de neurones qui traitent cette information, qui est aussi celle avec la plus grande acuité visuelle.
Comment se forment les images dans notre cerveau ?
Inserm. (2016). Au coeur des organes : L’œil et la vision [Vidéo]. Youtube. https://www.youtube.com/watch?v=sYLA6U1boF8
Exercices
Parcours de l’information visuelle
3.5 Rôle du cerveau dans la perception des couleurs
Nous savons que chez les humains, les trois opsines ont des sensibilités maximales à des longueurs d’onde correspondant approximativement aux couleurs primaires du rouge, du vert et du bleu. Cependant, nous ne voyons pas seulement trois couleurs. La couleur que nous percevons est le résultat du rapport de l’activité de nos trois types de cônes. Les humains ont une perception très sensible des couleurs et peuvent distinguer environ 500 niveaux de luminosité, 200 teintes différentes et 20 niveaux de saturation, soit environ 2 millions de couleurs distinctes. Ceci est possible parce que le cerveau combine les informations des différentes opsines. Un objet dont la couleur se situe quelque part dans le spectre visible va exciter à divers degrés les 3 types d’opsine dans les cônes. Un objet vert par exemple va surtout stimuler les cônes verts, mais aussi les rouges à un moindre degré et très légèrement les bleus. Notre perception des couleurs dépend donc de cette superposition des différents spectres d’absorption des trois types de cônes. Lorsque toutes les cellules coniques sont stimulées en proportions égales, la lumière blanche est perçue par le cerveau. Donc si on a seulement la capacité de percevoir le vert et le bleu, tout ce système est modifié.
4. Vision tétrachromatique, trichromatique et dichromatique
La vision chromatique a évolué il y a autour de 540 millions d’années chez les vertébrés. Selon le nombre de longueurs d’onde pour laquelle les opsines d’un système visuel ont une sensibilité maximale, on parlera de vision tétrachromatique, trichromatique ou dichromatique (sensibilité à 4, 3, ou 2 longueurs d’onde de couleur respectivement). On retrouve la vision tétrachromatique chez les poissons, les reptiles et les oiseaux. Il y a beaucoup de variations entre ces groupes de vertébrés et à l’intérieur de ces groupes, mais en général, ils perçoivent différentes longueurs d’onde qui correspondent aux ultraviolets et aux couleurs bleues, vert et rouge. Cependant, dans de nombreux cas, un ou plusieurs pigments ont été perdus, la vision des couleurs tétrachromatique ancestrale étant réduite à la trichromatie, dichromatie ou monochromatie. Par exemple, il y a plus de 200 millions d’années, les ancêtres des mammifères modernes ont divergé en 3 groupes : monotrèmes (ornithorynque), marsupiaux et euthériens (les mammifères placentaires). Des études génomiques suggèrent que les ancêtres des euthériens avaient une vision dichromatique. C’est encore le cas des mammifères euthériens existants à ce jour, comme les chiens et les rongeurs, sauf les exceptions dont nous parlerons dans quelques lignes (figure 18.10) [12]!

Vous vous dites probablement « mais pourquoi venons-nous de voir que les humains ont trois opsines et peuvent percevoir trois longueurs d’onde, ce qui nous donne une vision trichromatique? Nous sommes bien des mammifères, alors pourquoi sommes-nous trichromatiques? Pourquoi ne percevons-nous pas seulement deux longueurs d’onde? » Nous allons voir ce qui s’est passé au niveau des mécanismes cellulaires et évolutifs.
4.1 Lien entre la structure et la fonction de la protéine opsine
Nous avons vu qu’il y a trois types d’opsine chez les humains qui perçoivent trois longueurs d’onde. Il y a donc des différences entre ces opsines, puisque leur fonction diffère. Sachant que les opsines sont des protéines et qu’elles sont donc composées d’une chaine d’acides aminés, on peut prédire que ce qui change la sensibilité à une certaine longueur d’onde est la séquence en acide aminé de l’opsine. Des biologistes ont en effet découvert que si on change des acides aminés dans la chaine qui forme la protéine, on change la longueur d’onde à laquelle l’opsine est sensible. Ce fut une grande découverte en sciences de la vie! Ainsi, chez l’humain, il y a à trois endroits dans la séquence d’acides aminés qui diffèrent entre l’opsine LWS, qui est sensible à la longueur d’onde qui correspond au rouge, et l’opsine MWS, qui est sensible à la longueur d’onde qui correspond au vert : la position 180, 277 et 285. Nous avons vu les réponses à la lumière de chaque protéine opsine chez les organismes trichromates (figure 18.5 plus haut avec longueurs d’onde). Notez à quel point les courbes se ressemblent pour l’opsine M (vert) et l’opsine L (rouge) comparativement à l’opsine qui permet de percevoir le bleu. Les courbes des opsines M et L sont décalées d’environ 30 nm de réponse maximale. Les biologistes ont montré que les trois changements d’acides aminés sont assez pour causer ce changement. Un des changements d’acide aminé cause un déplacement de la sensibilité de 6 nm, le deuxième de 9 nm et le 3e de 15 nm. On peut donc avoir une opsine avec une nouvelle fonction avec l’évolution de seulement 3 acides aminés. Nous allons maintenant voir comment cette nouvelle opsine est apparue dans le génome des humains et autres grands singes, puisqu’elle n’est pas présente chez les mammifères en général.
Aubin-Horth, N. (2024). Écophysiologie évolutive: lien entre la séquence en acides aminés des opsines et leur fonction. [Vidéo]. Youtube. CC-BY. https://youtu.be/ytK1k4Q8g50?si=xdmTy-G_lJipt3aY
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien: Transcription_chapitre18
4.2 La duplication comme source de nouvelle fonction d’une opsine chez l’humain
Cette section est une adaptation de [13].
Parmi les mammifères, les primates sont les seuls à posséder une véritable vision trichromatique. Chez les primates de l’Ancien Monde, ou catarrhines, d’Afrique et d’Asie (y compris les humains), cette faculté a été acquise par une duplication d’environ 40 kb du gène LWS situé sur le chromosome X, qui se serait produite à la base de leur lignée (figure 18.11). Les gènes LWS dupliqués chez les primates de l’Ancien Monde ont divergé pour donner une copie en amont (OPN1LW) codant pour un pigment sensible à la longueur d’onde longue (l’opsine « L ») avec une sensibilité maximale autour de 560 nm et une copie en aval (OPN1MW) codant pour un pigment sensible à la longueur d’onde moyenne (M) avec une sensibilité maximale autour de 535 nm. C’est un exemple de néo-fonctionnalisation. La trichromie est donc obtenue par des cônes individuels exprimant une seule copie des pigments L ou M et par des cônes S exprimant le gène autosomique SWS1. Les régions codantes des gènes d’opsines L et M ont une homologie de séquences de 98 % contre seulement 40 % avec la séquence du gène codant pour l’opsine sensible au bleu (OPN1SW). La similarité de séquence est nécessaire et suffisante pour proposer que ces gènes soient des paralogues qui viennent d’une duplication.
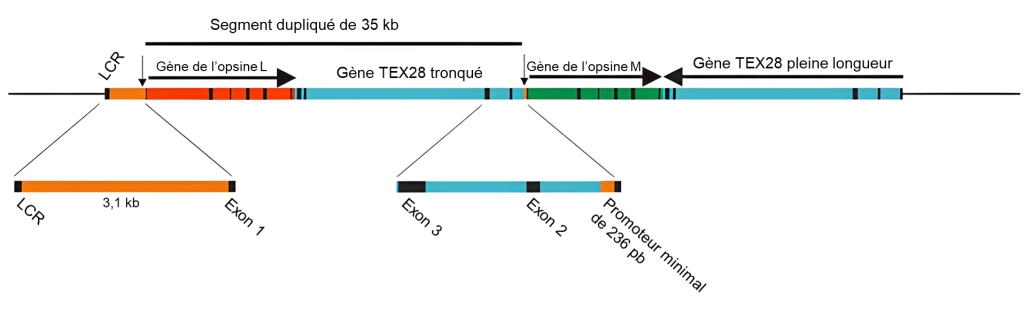
La plupart des primates du Nouveau Monde sont dichromates. Le mécanisme génétique sous-jacent à la trichromie chez les primates du Nouveau Monde, ou platyrrhines d’Amérique centrale et d’Amérique du Sud, n’est, à une exception près, pas basé sur un évènement de duplication, mais sur la présence d’allèles du gène LWS qui codent pour des opsines différentes avec des sensibilités à différentes longueurs d’onde. Puisque seules les femelles peuvent avoir deux chromosomes X (où est situé ce gène), la trichromatie complète ne se retrouve que chez les femelles qui sont hétérozygotes et ont un allèle de chaque type. La seule exception concerne le singe hurleur où la trichromie complète est présente chez les deux sexes. Ce phénomène est dans ce cas dû à une duplication similaire, mais indépendante, du gène LWS, comme celle observée chez les primates de l’Ancien Monde, donnant naissance à des gènes L et M distincts codant pour des pigments avec des sensibilités à différentes longueurs d’onde.
4.3 Les agents de sélection potentiels de la vision trichromatique chez les primates
La nature des pressions de sélection et les avantages (ou inconvénients) à l’origine de l’évolution de la vision trichromatique chez les primates continuent de faire l’objet de débats, avec des rôles proposés dans la recherche de fruits murs, la détection de jeunes feuilles plus nutritives et la détection des prédateurs portant un camouflage. Cependant, jusqu’à présent, aucune hypothèse unique n’a été démontrée pour expliquer de manière convaincante l’évolution et la conservation de la trichromie dans tous les cas. Il se peut donc que différentes combinaisons de tous ces facteurs soient actives chez différentes espèces.
4.3.1 L’hypothèse de la frugivorie
Depuis le XIXe siècle, la coloration des fruits a été comprise comme un trait qui a évolué parallèlement à la vision des couleurs chez les animaux. Le principal avantage de la vision des couleurs pour l’animal serait de permettre la détection de cibles clairement colorées sur un feuillage de fond vert tacheté dans lequel la luminosité varierait de manière aléatoire. En contrepartie, l’évolution de la coloration des fruits des plantes serait potentiellement liée à l’avantage de dispersion des graines créé par la consommation des fruits par des animaux mobiles [14]. Des études de modélisation visuelle ont prédit que les trichromates devraient avoir une meilleure discrimination dans la partie vert-rouge du spectre ce qui leur confèrerait un avantage pour la détection de fruits visibles. Des expériences comportementales ont fourni un certain soutien à cette hypothèse de la frugivorie, bien que des indications d’un net avantage des individus trichromatique pour la recherche de fruits comme nourriture en conditions naturelles reste encore à démontrer.
4.3.2 L’hypothèse de la folivorie
Il y a vingt ans, l’hypothèse de la frugivorie comme agent de sélection de la vision trichromatique a été remise en question par une hypothèse alternative de « folivorie » selon laquelle les jeunes feuilles comestibles, plutôt que les fruits murs comestibles, seraient systématiquement sélectionnées par les primates trichromatiques, en fonction de leur rougeur. Les partisans de l’hypothèse de la folivorie ont également suggéré que l’abondance de fruits clés dont la coloration les rend cryptiques dans le Nouveau Monde et à Madagascar (où on retrouve seulement certains lémurs qui sont aussi trichromates) pourrait ne pas favoriser l’évolution de la trichromie, puisque les jeunes feuilles ne sont jamais devenues un aliment essentiel dans ces endroits, comme elles l’ont été dans certaines régions habitées par des primates de l’Ancien Monde. Cette hypothèse semble se vérifier si l’on rappelle que les primates les plus folivores du Nouveau Monde, le singe hurleur, sont également les seuls platyrrhines à exprimer une trichromie complète. Étant donné leurs performances inférieures par rapport aux trichromates dans la détection d’aliments visibles, les dichromates peuvent compenser leur désavantage en identifiant les aliments cryptiques/camouflés, puisque le traitement neuronal des informations sur la couleur et la forme/texture se produit simultanément et de manière compétitive. Ainsi, les individus ayant une plus grande dépendance aux signaux de couleur (par exemple, les trichromates) seraient gênés par le bruit chromatique, tandis que ceux ayant une vision des couleurs plus faible (par exemple, les dichromates) bénéficieraient de l’évaluation des signaux achromatiques, importants pour l’identification des formes, des contours et des textures.
4.3.3 L’hypothèse de la prédation
Quelques études suggèrent que la couleur ne joue peut-être même pas un rôle essentiel dans la détection des aliments à courte distance chez les primates, et que d’autres forces de sélection (par exemple, la détection de prédateurs, la sélection sexuelle, les interactions sociales) devraient être examinées. Puisque la couleur peut être utilisée soit pour camoufler un objet par rapport à son arrière-plan, via un bruit chromatique, soit pour améliorer le visuel d’une cible, deux hypothèses non mutuellement exclusives peuvent être émises concernant les avantages et les inconvénients de la vision des couleurs pour la détection des prédateurs camouflés. En d’autres termes, le motif de couleur de certains prédateurs (par exemple, les félins jaunes tachetés de noir) peut interagir avec le motif de fond du feuillage vert d’une manière qui produit un bruit chromatique et permet uniquement l’identification des prédateurs par des signaux achromatiques, favorisant les dichromates. D’autre part, les mêmes prédateurs au pelage jaune peuvent également contraster avec le fond vert du feuillage, permettant leur détection par information chromatique, favorisant les trichromates. Grâce à la modélisation de la vision des couleurs et à des expériences comportementales, la seule étude à ce jour ayant testé l’hypothèse de détection des prédateurs a démontré que les trichromates excellaient par rapport aux dichromates lors de la recherche de prédateurs camouflés.
Cas appliqué
Texte adapté de [15].
Nous pouvons voir dans des conditions de faible luminosité grâce à nos bâtonnets. Ces cellules contiennent deux composants clés : le rétinal, qui est lié à une protéine, la rhodopsine. Lorsque la lumière frappe un bâtonnet, elle déclenche une cascade de réactions commençant par la transformation de la molécule de rétinal en une forme activée et se terminant par une impulsion nerveuse se propageant vers le cerveau. La forme activée du rétinal est toxique, mais tant qu’elle reste liée à la protéine rhodopsine, elle n’endommage pas le bâtonnet ou les cellules environnantes. Le rétinal toxique ne peut pas non plus réagir à la lumière. Il doit être libéré de la protéine et reconverti dans sa forme originale pour restaurer la vision dans la pénombre. Comme pour toutes les protéines, la structure de la rhodopsine comprend une chaine d’acides aminés. Les vertébrés terrestres possèdent tous le même acide aminé en position 122 dans leur rhodopsine. Cet acide aminé, nommé E122, aide à stabiliser la rhodopsine activée, ralentissant ainsi la libération du rétinal toxique. Mais l’E122 rend également les cellules en bâtonnets moins sensibles à la lumière, ce qui entraine une moins bonne vision dans la pénombre. En revanche, certains poissons n’ont pas l’acide aminé E122, mais ont plutôt une gamme d’autres acides aminés à cette position. Le laboratoire de Belinda Chang à University of Toronto s’est demandé pourquoi tous les animaux terrestres ont E122 et s’il existe d’autres options que l’évolution aurait pu explorer pour surmonter le compromis entre sensibilité à la lumière et stabilité (qui diminue la toxicité du rétinal). Les biologistes de ce laboratoire ont d’abord déterminé la composition des rhodopsines de vertébrés autres que les vertébrés terrestres, tels que les poissons, en séquençant de nombreuses espèces. Ils ont ensuite testé expérimentalement l’effet de remplacer E122 par un autre acide aminé observé chez ces espèces et ont démontré que la rhodopsine modifiée devenait plus sensible à la lumière de faible intensité, mais devenait aussi plus instable (figure 18.12).
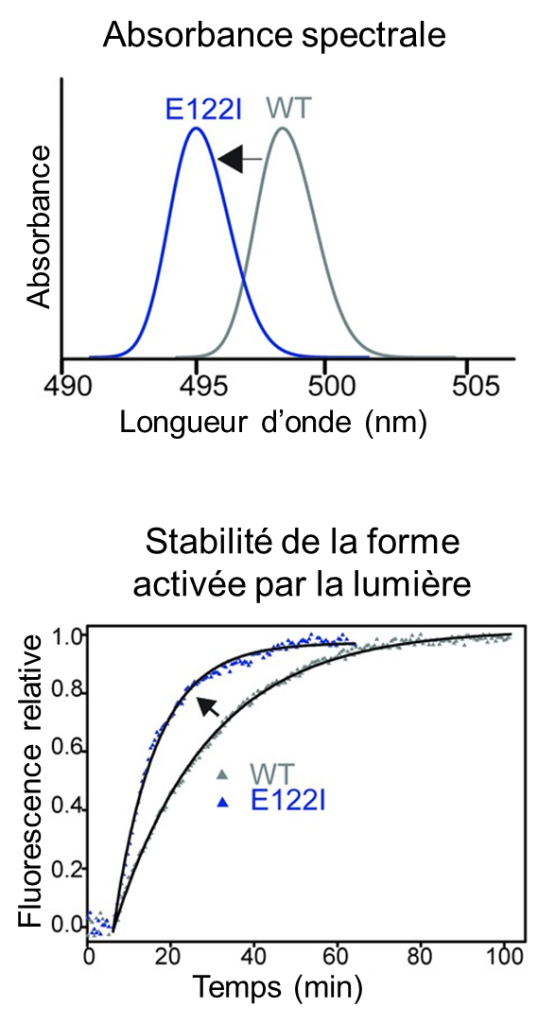
En examinant les différentes espèces, les membres du laboratoire Chang ont découvert d’autres sites dans la protéine où l’acide aminé change chaque fois que la position 122 n’est pas E122. Ils ont supposé que ces mutations ailleurs dans la protéine pouvaient « compenser » les effets négatifs sur la stabilité d’avoir un acide aminé autre que E122. Les biologistes ont testé l’effet de ces changements d’acides aminés sur la sensibilité et la stabilité en les remplaçant dans une rhodopsine artificielle qu’ils ont créée sans acide aminé E122. Comme prédit, ces changements dans d’autres acides aminés ont entièrement compensé la perte déstabilisante d’E122 sur la rhodopsine activée, mais sans sacrifier sa sensibilité à la lumière. Cependant, d’autres expériences ont ensuite confirmé qu’à moins que tous les acides aminés ne soient substitués en même temps, la rhodopsine activée est très instable. En effet, elle est presque aussi instable que les rhodopsines mutées trouvées dans certaines maladies humaines. Ces résultats suggèrent que, même s’il existe en principe une autre solution évolutive pour les animaux terrestres qui leur confèrerait une vision plus sensible dans la pénombre, les voies évolutives vers cette solution sont « bloquées », car elles sont toujours accompagnées par un risque accru de maladies oculaires. Ces résultats soulignent que la rhodopsine joue probablement un rôle plus important qu’on ne le pensait auparavant dans la protection des vertébrés terrestres contre les maladies oculaires.
Résumé
La perception de l’information visuelle chez l’humain débute dans la rétine. La lumière provenant du champ visuel est projetée en miroir renversé sur les deux rétines : le haut est en bas et la gauche est à droite. La rétine compte trois couches cellulaires : les photorécepteurs, les cellules bipolaires et les cellules ganglionnaires, dont les axones forment éventuellement le nerf optique. Les photorécepteurs sont de deux types, les cônes et les bâtonnets. Ils fonctionnent de la même façon, mais diffèrent dans leur photopigment, ce qui affecte leur sensibilité aux longueurs d’onde. Les bâtonnets contiennent de la rhodopsine, sont sensibles à la lumière de basse intensité et se retrouvent plus en périphérie qu’au centre de la rétine. Les cônes contiennent une opsine comme photopigment, qui sont sensibles à différentes longueurs d’onde selon leur séquence en acides aminés. La cascade cellulaire menant à la transformation d’un signal lumineux en signal nerveux débute avec la photoisomérisation du rétinal par des photons, ce qui active l’opsine et entraine une cascade de signalisation qui hyperpolarise la cellule photoréceptrice. Ceci modifie l’activité des cellules bipolaires, qui à leur tour affecte les potentiels d’action des cellules ganglionnaires, qui envoient un signal nerveux au cerveau. Les caractéristiques du signal visuel sont encodées par les cellules ganglionnaires qui communiquent de l’information sur l’objet observé (sa forme, sa couleur, son mouvement, etc.) ainsi que sur sa localisation spatiale. L’information de la rétine est transmise différemment au cerveau selon la section du champ visuel : la rétine temporale gauche se projette directement du côté gauche alors que la rétine nasale droite se projette du côté gauche à travers le chiasma optique. Il en résulte que le champ visuel droit de chaque œil est traité dans le cortex visuel gauche. De même, le champ visuel gauche de chaque œil est traité dans le cortex visuel droit. Les neurones qui traitent une image sont situés spatialement dans la même forme que cette image, dans la rétine, le thalamus et le cortex visuel, maintenant la topographie du champ visuel. La vision chromatique a évolué chez les vertébrés. Certains groupes sont tétrachromatique, comme les oiseaux et les poissons, alors que d’autres sont dichromatiques, comme les mammifères. Les primates sont une exception parmi les mammifères, car ils sont trichromatiques. Ceci est dû à l’évolution de la séquence en acide aminé des opsines qui a modifié la sensibilité aux longueurs d’onde. Ces mutations sont apparues après une duplication du gène codant pour une opsine, ce qui a mené à l’opsine L et M chez les grands songes de l’Ancien Monde, dont les humains. Il a été proposé que les agents de sélection qui ont pu contribuer à l’évolution de la trichromatie incluent la recherche de ressources alimentaires, la détection de prédateur ou les interactions sociales.
Activité de révision
Exercices
Révision sur la vision chromatique
Bibliographie
- Molnar, C. and J. Gair (2015). Vision, in Concepts of Biology – 1st Canadian Edition Opentext BC. https://opentextbc.ca/biology/chapter/17-5-vision/.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Vision, in Anatomy & Physiology [CC-BY-SA]. Oregon State University. https://open.oregonstate.education/aandp/chapter/15-5-vision/.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Structure of the Eye, in Anatomy & Physiology [CC-BY-SA]. https://open.oregonstate.education/aandp/chapter/15-5-vision/.
- Lussanet, M.d. (2017). Optical transformations [CC-BY-SA]. https://en.m.wikipedia.org/wiki/File:Optical-transformations.png.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Photoreceptor, in Anatomy & Physiology [CC-BY-SA]. https://open.oregonstate.education/aandp/chapter/15-5-vision/.
- Molnar, C. and J. Gair (2015). Rods and cones are photoreceptors in the retina, in Concepts of Biology – 1st Canadian Edition [CC-BY]. https://opentextbc.ca/biology/chapter/17-5-vision/.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Comparison of Color Sensitivity of Photopigments, in Anatomy & Physiology [CC-BY-SA]. https://open.oregonstate.education/aandp/chapter/15-5-vision/.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Retinal Isomers, in Anatomy & Physiology [CC-BY-SA]. https://open.oregonstate.education/aandp/chapter/15-5-vision/.
- Molnar, C. and J. Gair (2015). When light strikes rhodopsin, the G-protein transducin is activated, in Concepts of Biology – 1st Canadian Edition [CC-BY]. https://opentextbc.ca/biology/chapter/17-5-vision/.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Topographic Mapping of the Retina onto the Visual Cortex, in Anatomy & Physiology [CC-BY-SA]. https://open.oregonstate.education/aandp/chapter/15-5-vision/.
- Biga, L.M., S. Bronson, S. Dawson, A. Harwell, R. Hopkins, J. Kaufmann, M. LeMaster, P. Matern, K. Morrison-Graham, K. Oja, D. Quick, J. Runyeon, O. OERU, and OpenStax (2019). Ventral and Dorsal Visual Streams, in Anatomy & Physiology [CC-BY-SA]. https://open.oregonstate.education/aandp/chapter/15-5-vision/.
- Shichida, Y. and T. Matsuyama (2009). Evolution of opsins and phototransduction Philos Trans R Soc Lond B Biol Sci. 364(1531): p. 2881-95.
- Carvalho, L.S., D.M.A. Pessoa, J.K. Mountford, W.I.L. Davies, and D.M. Hunt (2017). The Genetic and Evolutionary Drives behind Primate Color Vision [CC-BY]. Frontiers in Ecology and Evolution. 5. https://www.frontiersin.org/articles/10.3389/fevo.2017.00034.
- Valenta, K., U. Kalbitzer, D. Razafimandimby, P. Omeja, M. Ayasse, C.A. Chapman, and O. Nevo (2018). The evolution of fruit colour: phylogeny, abiotic factors and the role of mutualists Scientific Reports. 8(1): p. 14302. https://doi.org/10.1038/s41598-018-32604-x.
- Castiglione, G.M. and B.S.W. Chang (2018). Functional trade-offs and environmental variation shaped ancient trajectories in the evolution of dim-light vision [CC-BY]. eLife. 7: p. e35957. https://doi.org/10.7554/eLife.35957.

