11. Les voies de signalisation comme traductrices des signaux de l’environnement
Introduction
Dans ce chapitre, nous étudierons la cause proximale de la plasticité, c’est-à-dire le mécanisme qui sous-tend le développement d’un phénotype ou d’un autre selon l’environnement. Comme le sujet du chapitre l’indique, on va voir que le signal de l’environnement qui détermine le développement est « traduit » en signal interne par des voies de signalisation qui impliquent des cascades d’expression de gènes, la sécrétion d’hormones et des modifications épigénétiques. Nous verrons que ces voies de signalisation doivent être étudiées en tenant compte de la dimension temporelle du développement. Nous nous attarderons au cas des polyphénismes, un type particulier de plasticité phénotypique. Nous verrons comment les biologistes ont étudié les causes proximales de ces phénotypes chez les insectes et les vertébrés, particulièrement le rôle des hormones.
Objectifs spécifiques
À la fin de ce chapitre, vous serez en mesure de :
- Décrire le rôle des voies de signalisation dans le développement d’un trait plastique.
- Expliquer l’importance de la série temporelle dans l’étude du développement plastique.
- Contraster la pléiotropie physiologique et la pléiotropie « génétique ».
- Expliquer le fonctionnement cellulaire des deux types de récepteurs hormonaux.
- Expliquer ce qui caractérise un polyphénisme.
- Expliquer le rôle de l’hormone juvénile dans le développement des castes chez les insectes sociaux.
- Expliquer le compromis lié à la plasticité de la durée du développement chez les amphibiens.
- Expliquer le rôle de l’hormone thyroïdienne et des glucocorticoïdes dans la plasticité du moment de la métamorphose chez les amphibiens.
Notions clés
- Les voies de signalisation impliquées dans le développement plastique
- La série temporelle
- La pléiotropie physiologique
- Les récepteurs hormonaux affectent la transcription
- Les polyphénismes
- Le signal de la nutrition
- L’hormone juvénile
- La plasticité de la durée du développement
- L’hormone thyroïdienne et les glucocorticoïdes
1. Les voies de signalisation impliquées dans le développement plastique
Nous avons vu que de grandes différences de phénotypes peuvent être le résultat de la plasticité phénotypique et que le développement de l’organisme est alors influencé par une variable de l’environnement. Il est fascinant de s’imaginer que l’environnement peut causer un changement de trajectoire dans le développement d’un organisme et encore plus de se demander comment cela se produit. Nous allons voir comment ce signal de l’environnement est transformé en « signal interne » qui affecte le développement. En étudiant la nature de ce signal interne, nous étudions les causes proximales du développement plastique.
Dans plusieurs cas de plasticité phénotypique, le signal de l’environnement est perçu par le système sensoriel qui peut activer directement une cascade de changements à travers l’activation de voies de signalisation. Celles-ci sont composées de nombreuses cascades d’expression de gènes, de sécrétions hormonales et de modifications épigénétiques. C’est le cas de la réponse des plantes à l’ombre, à la température ou au manque d’oxygène à la suite d’une inondation. Toutes ces conditions environnementales affectent l’élongation de leurs tiges à travers ces voies de signalisation (figure 11.1).
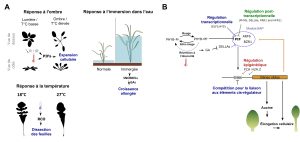
Si on résume, sans trop s’attarder aux noms des composantes d’une voie de signalisation spécifique, il y a une variable de l’environnement dont la valeur est perçue par un récepteur du système sensoriel, ce qui active 1) l’expression de gènes dont les produits font partie de cascades cellulaires, 2) la synthèse d’hormones qui vont activer leurs récepteurs, ainsi que 3) des modifications épigénétiques (comprenant la méthylation de l’ADN, la modification des histones et l’expression de petits ARN). Ensemble, ces évènements ont pour effet de modifier quels gènes sont exprimés et quelles protéines sont présentes dans la cellule, ce qui affecte le phénotype final de l’organisme.
Cette vidéo présente une des façons par laquelle le signal de l’environnement est transformé en « signal interne » à travers différentes voies.
Aubin-Horth, N. (2024). Écophysiologie évolutive: les hormones comme traductrices des signaux de l’environnement. [Vidéo]. Youtube. CC-BY. https://youtu.be/c3dVXeyxMC4?si=_ML_2vbRjCfOZ9N6
Vous trouverez la transcription de l’audio de cette capsule en cliquant sur ce lien: Transcription en format word
2. La série temporelle
Lorsqu’on veut étudier les causes proximales d’un trait plastique, on doit tenir compte du fait qu’on étudie le développement et qu’il y a donc un aspect temporel à notre étude. En effet, les différentes étapes du développement plastique vont se dérouler à des temps précis qui doivent être déterminés par les biologistes. Il y a un moment où le signal de l’environnement est perçu et où il est traduit en signal interne, et c’est un aspect qui nous intéresse. Puis, le développement de traits à différents niveaux d’organisation biologique, qui ont chacun leur propre cause proximale, se déroule à des moments particuliers du développement, dans un ordre précis, et c’est également un aspect important. Pour disséquer toute cette suite d’événements dans le temps, il sera nécessaire de faire des mesures de différents traits afin de déterminer lesquels diffèrent entre les phénotypes plastiques et aussi quand ils diffèrent. On peut penser par exemple à mesurer le niveau d’une hormone. Pour comprendre la cascade de signalisation, il faut aussi savoir où sont localisés les récepteurs de cette hormone, afin de déterminer quel tissu reçoit le signal et est impliqué dans la suite du développement.
Prenons l’exemple de la taille et la forme finale des organes des insectes qui ont un stade larvaire distinct du stade adulte. La taille et la forme sont le produit d’une croissance contrôlée à la fois par le programme de développement ainsi que par l’environnement durant le stade larvaire (figure 11.2). Le schéma représente le développement dans le temps de la forme et de la taille du disque imaginal d’une larve d’insecte. Le disque imaginal est le nom qu’on donne au regroupement de cellules souches qui vont se différencier en un organe au moment de la métamorphose, ici une aile. Les voies de signalisation qui régulent la croissance et la forme des ailes chez les insectes impliquent des morphogènes (les molécules qui diffusent dans l’organisme en développement et qui affectent la différenciation cellulaire), ainsi que celles liées aux hormones, telles que l’ecdysone, l’hormone juvénile et l’insuline. Le développement est un processus complexe et les disques imaginaux sont aussi affectés par d’autres voies de signalisation liées à la détection des nutriments (ex. : la voie TOR). Les différences de taille du disque imaginal selon l’environnement (la plasticité) seront reflétées dans la taille de l’aile de l’adulte.

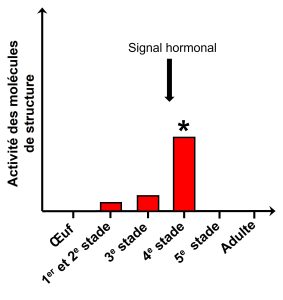
Les biologistes qui veulent comprendre les mécanismes de la plasticité vont devoir faire ces mesures pour plusieurs stades du développement, pour trouver exactement à quel moment durant le développement le signal de l’environnement est important et quand le signal interne est enclenché. On doit donc faire ce qu’on appelle « une série temporelle ». Prenons le cas du développement plastique chez le criquet, qui a habituellement une forme solitaire mais qui peut exprimer une forme grégaire si l’environnement change. La forme grégaire se déplace en énormes groupes qui s’alimentent en masse et détruisent les récoltes des humains, causant des catastrophes en agriculture. Le signal environnemental qui enclenche le développement de la forme grégaire est la densité des individus de forme solitaire. Cette densité est traduite en signal interne à travers un signal hormonal qui à son tour enclenche une cascade d’expression de gènes. Certains gènes sont exprimés à un moment précis du développement (figure 11.3). Ainsi, si on étudie seulement les différences dans le phénotype final des criquets grégaires et solitaires, on aura certaines réponses sur les causes proximales, mais on manquera assurément le signal initial qui a enclenché tout ce développement alternatif selon l’environnement.
3. La pléiotropie physiologique
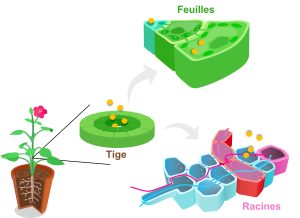
Dans plusieurs cas de plasticité phénotypique, le signal de l’environnement est transformé en signal interne grâce à l’action d’une hormone. Le rôle de traductrice des hormones dans le développement plastique n’est pas surprenant, si on pense aux hormones comme des messagers chimiques qui peuvent affecter simultanément plusieurs organes qui expriment les récepteurs pour cette hormone (figure 11.4). Ces effets en parallèle sur plusieurs fonctions biologiques sont appelés de la « pléiotropie physiologique », par analogie avec la pléiotropie génétique, où le produit d’un gène a des effets sur plusieurs traits. Le fait qu’une hormone puisse affecter plusieurs tissus permet de coordonner des changements de plusieurs compartiments biologiques. Par exemple, une hormone peut exercer une influence à la fois sur le métabolisme, la répartition de l’énergie, la reproduction, le comportement et le système immunitaire. Avoir un messager chimique puissant comme une hormone dans un organisme multicellulaire est crucial pour obtenir une réponse coordonnée qui donnera un phénotype intégré. Dans le cas d’une plante (figure 11.4), si les différents organes ne se développent pas de façon coordonnée sous l’effet de l’hormone, les systèmes physiologiques ne pourront pas fonctionner en harmonie, ce qui affectera la performance et le fitness de l’individu.
4. Les récepteurs hormonaux affectent la transcription
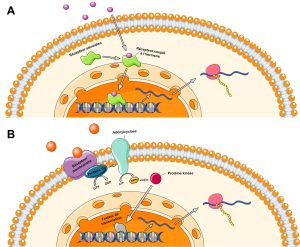
Le signal hormonal enclenche une cascade de changements cellulaires, incluant des changements dans le niveau d’expression de gènes qui vont mener aux phénotypes distincts qui résultent de la plasticité phénotypique. En effet, plusieurs hormones ont des récepteurs qui, une fois activés, agissent comme des facteurs de transcription qui modulent l’expression de dizaines, voire de centaines de gènes (figure 11.5A). Leurs récepteurs sont habituellement des récepteurs nucléaires. D’autres récepteurs hormonaux activent des cascades signalétiques dans la cellule où ils sont exprimés, ce qui a souvent un effet sur la transcription de gènes (figure 11.5B). Ces récepteurs sont habituellement des récepteurs membranaires. Dans les deux cas, ces différences d’expression se passent à des stades précis du développement et enclenchent à leur tour toute une suite de changements d’expression d’autres gènes, de développement de certains tissus, de fonctionnements d’organes et de systèmes physiologiques, qui vont mener aux changements irréversibles et stables de phénotypes que nous observons une fois le développement plastique terminé.
5. Les polyphénismes
La réponse plastique à l’ombre chez les plantes que nous avons vu plus haut est un trait plastique continu. En effet, l’élongation de la tige est fonction de la variable environnementale et peut prendre plusieurs valeurs. Il existe cependant une forme particulière de plasticité où les phénotypes retrouvés en nature sont discrets (ex. : absence ou présence d’un trait, coloration distincte, morphologie complètement différente) et non une variable continue. On les nomme alors des polyphénismes (figure 11.6).

6. Les castes chez les insectes
Chez les insectes sociaux, seulement les reines, qui constituent une petite partie des individus de la colonie, se reproduisent, tandis que les ouvrières partagent les autres tâches qui comprennent la construction, l’entretien et la défense du nid, la collecte de nourriture et l’élevage du couvain. De même, certaines espèces de fourmis abritent des castes spéciales d’ouvrières particulièrement importantes, les « soldats », qui jouent un rôle préférentiel dans la défense des colonies, ou pour découper ou transporter de gros objets, y compris des proies. La morphologie, la physiologie et le comportement diffèrent donc profondément entre les castes. Par exemple, un soldat peut avoir 100 fois la masse corporelle d’une ouvrière et les reines de certaines espèces vivent plusieurs décennies, alors que les ouvrières meurent généralement après quelques mois. Ce sont tous des exemples de plasticité menant à un polyphénisme.
Dans le cas des insectes sociaux comme les abeilles, chaque embryon femelle a le potentiel de devenir une ouvrière ou la reine, à partir du même génome. L’environnement durant leur développement envoie un signal différent se traduisant en signal interne qui va provoquer une cascade de changements d’expression de gènes, ce qui va entrainer des voies de développements complètement différentes. Une fois ce signal de l’environnement intégré dans le développement, on voit que les individus ont le même génome, mais ont des différences dans l’expression de centaines de gènes, ce qui donne les castes si différentes.
6.1. Le signal de la nutrition
Quel est le signal de l’environnement qui affecte le fait de devenir une reine ou une ouvrière? Selon l’espèce, les biologistes ont recensé des effets de l’alimentation, de la température et des phéromones sécrétées par les autres membres du groupe. Dans le cas spécifique d’une larve d’abeille mellifère, l’alimentation joue un rôle clé dans son développement plastique. Si elle reçoit seulement de la gelée royale durant tout son stade larvaire, elle deviendra une reine, alors qu’une larve dont la diète ne contient de la gelée royale qu’au début de son développement et ensuite du pollen et d’autres sources de nutriments deviendra une ouvrière. La différence d’alimentation correspond non seulement au fait que la reine reçoit de la gelée royale plus longtemps, mais aussi qu’elle reçoit exclusivement cette source de nourriture. Le signal environnemental est donc ce qu’elle mange et aussi ce qu’elle ne mange pas. On sait aussi que la quantité totale de nourriture donnée à une larve par les ouvrières affectera son développement en reine. Il y a donc de nombreux aspects de l’environnement qui affectent le développement de ce polyphénisme.
6.2. L’hormone juvénile
Des biologistes se sont demandé ce que cette alimentation affecte et ont découvert que l’alimentation riche de la future reine est associée avec un maintien de la présence du corps allate. Le corps allate est une paire de glandes qui se retrouvent dans la région du cou chez les insectes. C’est une glande endocrine, c’est-à-dire qu’elle sécrète des hormones. Une hormone qui est sécrétée par le corps allate est l’hormone juvénile (JH) (figure 11.7A). Les entomologistes intéressés par la fonction de cette glande et de cette hormone ont d’abord manipulé la source de l’hormone et quantifié comment cela affecte le phénotype de l’animal en utilisant l’approche d’ablation et de remplacement. Ce sont les premières expériences qui ont été faites pour étudier la fonction de cette hormone, car c’est relativement facile de faire une chirurgie sur un insecte. Dans ce cas-ci, les biologistes étudiaient le développement des insectes en général, et non le développement plastique. Par exemple, si on fait l’ablation du corps allate d’une larve d’insecte, elle se métamorphose en minuscule adulte (figure 11.7B). Il semble donc que l’hormone juvénile est nécessaire pour contrôler la métamorphose du stade larvaire au stade adulte, car ici le stade adulte est atteint trop tôt, ce qui affecte la taille. D’un autre côté, si on effectue un remplacement en donnant un extrait de corps allate broyé à une larve qui est arrivée au moment de son développement où elle devrait se métamorphoser (et donc qui ne sécrète pas naturellement d’hormone juvénile), elle continue au stade larvaire et mue en une larve géante au lieu de se métamorphoser en adulte (figure 11.7C). Le rôle de l’hormone juvénile semble être de maintenir l’insecte au stade juvénile. D’où son nom!
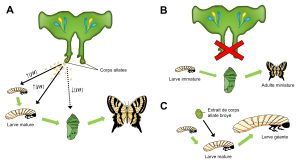
Une autre façon d’analyser le rôle de l’hormone juvénile est de mesurer le niveau de cette hormone dans un individu d’un phénotype donné. Quelques années après les études d’ablation et de remplacement du corps allate, la technologie s’est améliorée au point qu’on puisse mesurer le niveau d’une hormone dans un échantillon aussi petit qu’un insecte. Ça ne fait pas si longtemps que c’est possible! Ici, les biologistes pouvaient étudier la plasticité spécifiquement, en étudiant les castes chez l’abeille. Des mesures sur des larves d’abeille qui ont été nourries uniquement à la gelée royale, qui vont donc devenir des reines, et sur d’autres larves qui n’ont pas reçu cette alimentation, et qui vont donc devenir des ouvrières, ont montré que le niveau d’hormone juvénile augmente avec le temps dans les larves de reine seulement. Les chercheur.es ont supposé que c’est cette hormone qui cause le développement plastique en reine. Cependant, est-ce qu’ils ont véritablement démontré ici que l’hormone cause la plasticité du développement en caste chez l’abeille? La réponse est non, car ils ont seulement démontré une association. Une fois qu’on voit une association entre la caste dans laquelle se développe une larve d’abeille et le niveau d’une hormone, on peut faire une analyse fonctionnelle.
Exercices
Vérifiez votre compréhension des approches que l’on peut utiliser pour étudier la fonction d’une hormone avec ce quiz formatif.
Effet de l’hormone juvénile sur la plasticité des castes
7. La plasticité de la durée du développement des amphibiens
Les amphibiens ont des stades de vie distincts, avec un stade larvaire et un stade adulte. Si on prend l’exemple des crapauds, on voit qu’ils ont un stade juvénile aquatique, le têtard, et un stade adulte terrestre. Toute une série de changements physiologiques doivent se produire pour passer d’un environnement aquatique à un environnement terrestre.
Dans le cas des crapauds, il n’y a pas de patrons divergents de développement qui mènent à des phénotypes complètement différents comme pour les castes des abeilles. Ce qu’on observe c’est plutôt un changement dans la durée du développement, ce qui mène aussi à d’importantes différences de phénotypes. Le moment où l’individu passe d’un stade à l’autre peut en effet être un trait plastique influencé par l’environnement externe. Ainsi, certaines espèces de crapauds peuvent se métamorphoser en adulte à un âge variable, selon les conditions environnementales. Ces espèces passent leur premier stade de vie dans des milieux aquatiques qui varient dans leurs caractéristiques d’une année à l’autre, entre autres dans la durée des mares d’eau avant l’assèchement. D’une année à l’autre, l’assèchement se passe plus ou moins rapidement et la durée de la période larvaire jusqu’à la métamorphose en stade adulte varie aussi de façon plastique. C’est le cas de Pelobates cultripes (figure 11.8A). Des conditions de bas niveau d’eau entrainent une période larvaire 40 % plus courte que lorsque les conditions sont constantes sans baisse du niveau d’eau (figure 11.8B). Ce développement plus rapide permet de survivre à l’assèchement en se déplaçant vers le milieu terrestre mais engendre un adulte plus petit, avec de plus courtes pattes arrière et moins de réserve de gras, comparé au phénotype de la même espèce lorsqu’elle se développe en condition bénigne où la mare reste constante et que la métamorphose se produit à un âge plus avancé. La taille à l’âge adulte affecte la survie et le succès reproducteur des crapauds. Une taille plus petite entraine une survie plus faible et un moins bon succès reproducteur. Il y a donc un compromis entre la survie jusqu’à l’âge adulte et le fitness. En effet, si le têtard ne se développe pas rapidement en adulte dans les conditions de niveau d’eau bas, il meurt asséché, mais s’il se développe rapidement et survit, il a une petite taille qui affecte son fitness adulte.
D’autres espèces de crapauds n’ont pas cette plasticité de la durée de la période larvaire et ont toujours un temps de développement très court. C’est le cas de Scaphiopus couchii, qui exploite des environnements très éphémères, comme des mares d’eau présentes pendant seulement quelques semaines, année après année (figure 11.8A). Puisque ces crapauds ont toujours un temps de développement court jusqu’à la métamorphose, ils sont toujours petits, avec de courtes pattes et peu de gras abdominal. Leur développement n’est pas plastique, car même si on les met dans un environnement bénin constant en laboratoire, ils se développent rapidement (figure 11.8B). Il y a donc de la variation inter-espèce pour la plasticité de la durée du développement. ll y a de la variation génétique pour leur norme de réaction (figure 11.8B).
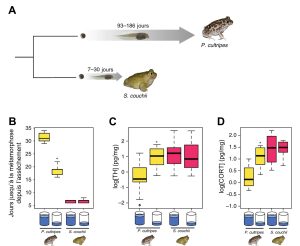
Ces deux espèces sont intéressantes à comparer pour les biologistes qui veulent étudier les causes proximales de la plasticité du temps de développement. Est-ce que les niveaux hormonaux mesurés chez l’espèce non plastique S. couchii, qui se développe toujours rapidement, seront aussi présents chez l’espèce plastique P. cultripes lorsqu’elle se développe rapidement? Autrement dit, est-ce que le signal de l’environnement affecte l’activité du réseau de régulation de la métamorphose en modifiant les niveaux d’hormones impliquées dans ce changement de stade de vie observé chez pratiquement tous les amphibiens?
7.1 L’hormone thyroïdienne et les glucocorticoïdes
Les biologistes intéressés à la plasticité de la métamorphose chez les amphibiens ont déjà des hormones candidates à étudier. En effet, de nombreuses études ont déjà démontré que l’hormone thyroïdienne et la corticostérone (qui fait partie des glucocorticoïdes) sont impliquées dans la transition entre le stade juvénile aquatique et le stade adulte terrestre chez plusieurs espèces d’amphibiens qui n’ont pas de développement plastique. Ces deux hormones ont des récepteurs qui agissent comme des facteurs de transcription et elles affectent une myriade de traits. Chez les espèces qui ne sont pas plastiques pour le temps de développement, on sait que ces hormones sont sécrétées en grande quantité juste avant la métamorphose.
Les herpétologistes ont mesuré les niveaux d’hormone au même stade de vie des têtards pour deux groupes par espèce : un groupe est dans un environnement avec des niveaux stables d’eau et l’autre groupe fait face à une réduction du niveau de l’eau. Ce qui est vraiment intéressant, c’est que l’espèce qui n’est pas plastique (S. couchii) et qui a un stade têtard court dans toutes les conditions hydriques, a de hauts niveaux d’hormone thyroïdienne et de corticostérone, peu importe qu’on la place expérimentalement dans un milieu ou dans l’autre (figure 11.8 C et D). À son stade de têtard, elle a donc le même pic hormonal typique d’un amphibien qui se prépare à la métamorphose, peu importe l’environnement dans lequel elle se trouve. Dans le cas de notre espèce de crapaud plastique dans la durée de son développement, P. cultripes, les herpétologistes ont démontré que lorsque l’environnement est défavorable et que la quantité d’eau diminue, il y a un signal hormonal clair : les deux hormones augmentent significativement, alors que le pic hormonal n’est pas visible au même stade de vie lorsque les individus sont dans un environnement hydrique stable (figure 11.8 C et D). À la suite de cette expérience, les herpétologistes ont suggéré que la cause proximale de la plasticité du temps de développement est le niveau de ces deux hormones, ce qui pourrait être vérifié à l’aide d’une analyse fonctionnelle en manipulant les niveaux d’hormone et en étudiant les effets sur le développement.
Cas appliqué
Plasticité de la morphologie alimentaire des nématodes
Pour illustrer le rôle des hormones comme messagers à l’interface entre l’environnement et la physiologie de l’organisme, nous étudierons un exemple de polyphénisme qui se retrouve chez de petits invertébrés, les nématodes (figure 11.9). Les nématodes sont partout et ont de nombreux rôles dans les écosystèmes.
Les biologistes ont observé que dans certaines espèces de nématode, certains individus ont des mâchoires avec des dents alors que d’autres n’en ont pas. Elles ont aussi remarqué que les individus avec des dents mangent d’autres nématodes plutôt que des bactéries.
Cette vidéo montre un nématode de l’espèce P. pacificus se nourrissant d’un nématode de l’espèce Caenorhabditis elegans. Description de la vidéo : Un nématode de grande taille (Pristionchus pacificus) tient dans sa bouche un nématode de petite taille (Caenorhabditis elegans) par le centre de son corps. Tranquillement, il l’aspire dans sa bouche, mais il ne réussit pas encore à la fin de la vidéo de 2 min à le manger complètement. La vidéo est accompagnée d’une musique dramatique.
Bumbarger, D. (2013). P. pacificus eats C. elegans! [Vidéo]. Youtube. https://www.youtube.com/watch?v=vT8bms2RHe8&ab_channel=DanBumbarger
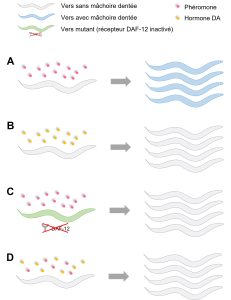
Les biologistes se sont demandé si cette variation phénotypique dans la forme de la mâchoire des nématodes provient de variation génétique ou bien si elle est le résultat de la plasticité phénotypique. Elles ont donc testé si certaines conditions de l’environnement affectent le développement des mâchoires avec des dents. Elles ont testé l’effet de la température et du pH sans voir d’effet sur le développement. Cependant, elles ont démontré que la famine cause un développement de la mâchoire avec des dents, tout comme la présence de phéromones de la même espèce (figure 11.10). Les phéromones sont des molécules similaires aux hormones qui servent de signal à l’extérieur du corps des individus qui les sécrètent. De plus, les phéromones d’une autre espèce de nématode, C. elegans, déclenchent aussi le développement de la mâchoire « dentée » [15, 16].
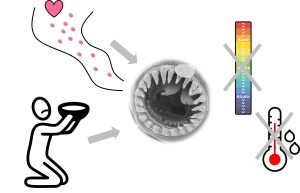
La question que les biologistes se sont posée était « qu’est-ce qui transforme le message de l’environnement (présence de proie, haute densité, famine…) en message interne qui dirige le développement vers un phénotype ou un autre? ». Les nématodes sont très simples, ce qui rend cette question plus facile à étudier que dans un vertébré. On sait déjà que, dans plusieurs invertébrés, dont le nématode C. elegans, le signal des phéromones en général est transformé en signal cellulaire interne à travers une cascade cellulaire impliquant une famille d’hormones stéroïdiennes trouvées chez certains invertébrés, les acides dafachroniques («DA»). Ici, ce qui est particulier, c’est que les phéromones bloquent l’activité de cette hormone DA, qui agit elle-même en désactivant un récepteur nucléaire (DAF-12). Une hormone qui désactive l’activité d’un récepteur, ça peut être surprenant, mais ça existe! Cette cascade de signalisation est connue pour la réponse aux phéromones qui n’est pas plastique : s’il y a des phéromones, l’hormone DA n’est pas active et donc le récepteur DAF-12 est activé et agit comme facteur de transcription sur plusieurs traits.
En se basant sur les observations de cette cascade dans cette espèce (C. elegans), les biologistes ont émis l’hypothèse que, étant donné que l’hormone DA est impliquée dans la cascade de signalisation des phéromones, cette hormone pourrait aussi être impliquée dans le développement de polyphénismes plastiques qui sont activés par des phéromones chez le nématode P. pacificus. Leur prédiction était que si elles manipulent la quantité d’hormone DA, cela affectera la proportion de vers qui développent une mâchoire avec des dents. On peut faire deux types de manipulations : la première est d’imiter la présence de phéromones en bloquant le signal de l’hormone DA, avec la prédiction précise que cela résultera en plus de vers qui ont des mâchoires pour manger d’autres vers. Inversement, si on imite l’absence de phéromones en augmentant la quantité d’hormone DA, cela désactivera le récepteur DAF-12 et la prédiction est qu’on aura moins de vers avec une mâchoire à dents. Elles ont fait différentes expériences de manipulation pharmacologique pour tester ces prédictions (voir figure 11.11).
- Elles ont exposé des vers à des doses de plus en plus grandes de phéromones venant d’autres vers. Elles ont démontré comme dans des études précédentes que ce traitement engendre davantage de vers avec une mâchoire dentée (figure 11.11A).
- Elles ont exposé les vers durant leur développement à des doses de plus en plus fortes d’hormone DA et ont quantifié la proportion de nématodes qui avaient une mâchoire à dents. Comme dans leur prédiction, plus la dose d’hormone était forte, moins de vers avaient une mâchoire dentée (figure 11.11B).
- Elles ont fait une expérience avec une dose de phéromone qui avait donné presque 100 % de vers à mâchoire dentée, mais elles ont utilisé des nématodes mutants dont le récepteur DAF-12 est complètement inactivé. Elles n’ont obtenu aucun vers avec une mâchoire dentée, ce qui suggère que le signal des phéromones passe entièrement par cette cascade signalétique (figure 11.11C).
- Elles ont exposé des vers sans mutation à des phéromones ET elles ont ajouté l’hormone DA, qui sont deux « messages » contradictoires. Elles ont trouvé une dose d’hormone DA qui réussit à bloquer le signal des phéromones, qui entraine habituellement le développement d’une mâchoire dentée (figure 11.11D). Le lien entre les phéromones et la cascade de signalisation de DAF est maintenant très clair.
C’est un bon exemple de comment les hormones permettent de relier le monde extérieur au monde intérieur de l’organisme, d’être les traductrices à l’interface entre l’environnement et la physiologie des organismes.
Résumé
Les causes proximales de la plasticité impliquent des voies de signalisation qui peuvent être classées en trois catégories qui agissent de concert durant le développement 1) l’expression de gènes dont les produits font partie de cascades cellulaires, 2) la synthèse d’hormones qui vont activer leurs récepteurs, 3) des modifications épigénétiques (comprenant la méthylation de l’ADN, la modification des histones et l’expression de petits ARN). Lorsqu’on veut étudier les causes proximales d’un trait plastique, on doit tenir compte du fait qu’on étudie le développement et qu’il y a donc un aspect temporel à notre étude. Les hormones jouent un rôle central dans le développement des différents phénotypes, plastiques ou non car ce signal qui passe par la circulation sanguine peut affecter de nombreux tissus. Cette pléiotropie physiologique résulte en des changements dans différentes fonctions biologiques de façon concertée. L’hormone juvénile est impliquée dans le polyphénisme des castes chez les insectes sociaux, ce qui a été déterminé en mesurant les niveaux dans différentes castes et en manipulant les niveaux de cette hormone afin de quantifier les effets sur le développement. Ces deux approches ont permis d’émettre l’hypothèse que cette hormone était la cause du développement divergent entre les reines et les ouvrières chez les abeilles. La plasticité du développement peut s’observer dans une variation dans la durée d’un des stades de vie, tel que le stade têtard chez les amphibiens. Cette capacité de se développer plus rapidement lorsque l’environnement est défavorable entraine un compromis entre la survie au stade larvaire et le fitness au stade adulte. L’hormone thyroïdienne et les glucocorticoïdes sont impliqués dans la métamorphose vers le stade adulte chez les crapauds et servent possiblement de traductrices entre les changements dans l’environnement et l’organisme dans le cas de la plasticité du temps de développement.
Activité de révision
Exercices
Révision sur les voies de signalisation
Bibliographie
- Fritz, M.A., S. Rosa et A. Sicard (2018). Mechanisms underlying the environmentally induced plasticity of leaf morphology [CC-BY]. Frontiers in Genetics, 9, https://www.frontiersin.org/articles/10.3389/fgene.2018.00478.
- Mirth, C.K. et A.W. Shingleton (2019). Coordinating development: How do animals integrate plastic and robust developmental processes? [CC-BY]. Frontiers in Cell and Developmental Biology, 7, https://www.frontiersin.org/articles/10.3389/fcell.2019.00008.
- Chen, S., P. Yang, F. Jiang, Y. Wei, Z. Ma et L. Kang (2010). De novo analysis of transcriptome dynamics in the migratory locust during the development of phase traits [CC-BY]. PLoS One, 5(12). https://doi.org/10.1371/journal.pone.0015633
- Song, K. (2013). Plant [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Plant.svg
- Song, K. (2013). C4 photosynthesis is less complicated [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:C4_photosynthesis_is_less_complicated.svg
- Song, K. (2013). Into the stele [CC-BY-SA]. https://commons.wikimedia.org/wiki/File:Into_the_stele.svg
- Servier Medical Art. [CC-BY]. https://smart.servier.com/
- Prof. Dr. Otto Wilhelm Thomé Flora von Deutschland (2006). Illustration Ranunculus aquatilis1 [domaine public]. https://commons.wikimedia.org/wiki/File:Illustration_Ranunculus_aquatilis1.jpg
- Sandias, A. (2007). Termites polymorphism [domaine public]. https://commons.wikimedia.org/wiki/File:Termites_polymorphism.jpg
- Eckstein, K. (1913). Image from page 135 of « Die Schmetterlinge Deutschlands mit besonderer Berücksichtigung ihrer Biologie » [domaine public]. https://www.flickr.com/photos/internetarchivebookimages/20935271602/in/photostream/
- Username1927 (2016). Holometabolous vs. Hemimetabolous [CC-BY-SA]. https://commons.wikimedia.org/w/index.php?curid=49034418
- Singh Kaleka, A., N. Kaur et G. Kour Bali, Larval Development and Molting, dans Edible Insects. 2019, [CC-BY]. IntechOpen.
- Kulkarni, S.S., R.J. Denver, I. Gomez-Mestre et D.R. Buchholz (2017). Genetic accommodation via modified endocrine signalling explains phenotypic divergence among spadefoot toad species [CC-BY]. Nature Communications, 8(1). https://doi.org/10.1038/s41467-017-00996-5
- Robbie Rae, A.S., and Ralf J. Sommer (2012). P. pacificus WT un-ablated [CC-BY]. https://commons.wikimedia.org/wiki/File:Pristionchus_pacificus_g001_(1).jpg
- Bento, G., A. Ogawa et R.J. Sommer (2010). Co-option of the hormone-signalling module dafachronic acid-DAF-12 in nematode evolution. Nature, 466(7305), 494. https://doi.org/10.1038/nature09164
- Susoy, V., E.J. Ragsdale, N. Kanzaki et R.J. Sommer (2015). Rapid diversification associated with a macroevolutionary pulse of developmental plasticity [CC-BY]. eLife, 4. https://doi.org/10.7554/eLife.05463
- Red Cross Red Crescent Climate Centre (2017). Famine [CC0]. https://thenounproject.com/icon/famine-27826/
- Olgio, M. (2012). Thermometer [CC0]. https://thenounproject.com/icon/thermometer-7276/
- Kirkendoll, H. (2009). Power of Hydrogen (pH) chart [CC0]. https://commons.wikimedia.org/wiki/File:Power_of_Hydrogen_%28pH%29_chart.svg
- Froehlich, J.J. (2022). Tissues of caenorhabditis elegans [CC-BY-SA]. https://commons.wikimedia.org/w/index.php?curid=122457897
- Healthcare Symbols (2017). Tooth [CC0]. https://thenounproject.com/icon/tooth-572/

